PRIMA FACOLTA' DI MEDICINA E CHIRURGIA - CLM "B"
SAPIENZA UNIVERSITA' DI ROMA
La materia e' costituita da particelle piccolissime (atomi e molecole); questo spiega, ad esempio, gli esperimenti di diffusione gassosa e la composizione percentuale in peso delle sostanze secondo rapporti precisi e costanti degli elementi costituenti. La chimica deve descrivere la struttura di queste particelle, le piu' semplici delle quali sono gli atomi.
Gli esperimenti sull'elettricita' avevano chiarito fin dalla fine del '700 che la materia e' composta da particelle con carica elettrica positiva o negativa; ogni ipotesi sulla struttura dell'atomo doveva prevederne l'esistenza.
Nel corso della storia della chimica furono proposti vari modelli della struttura dell'atomo. Il primo modello effettivamente capace di spiegare le proprieta' di queste particelle e' quello elaborato dal fisico danese Niels Bohr, che prevede un nucleo centrale, picccolo e molto denso, con carica elettrica positiva e delle particelle piu' piccole, gli elettroni che ruotano intorno al nucleo. L'atomo di Bohr e' quindi simile ad un sistema solare in miniatura, con un sole al centro (il nucleo) e vari pianeti che gli orbitano intorno (gli elettroni). L'ATOMO DI BOHR E' INOLTRE QUANTISTICO: si intende con questo termine che l'elettrone ruota soltanto su alcune orbite stabili e puo' trovarsi soltanto a certe distanze dal nucleo. Bohr riteneva che fossero stabili soltanto quelle orbite la cui circonferenza era un multiplo intero della lunghezza d'onda della radiazione elettromagnetica associata all'elettrone.

Figura 1: il modello atomico planetario e quantistico di Niels Bohr per l'atomo di idrogeno.
Il modello attuale della struttura dell'atomo deriva da quello di Bohr e ne mantiene alcune delle caratteristiche principali.
L'atomo e' costituito da un NUCLEO centrale che ne contiene quasi tutta la massa ed ha carica elettrica positiva, e dagli ELETTRONI, molto piu' piccoli, che ruotano intorno al nucleo ed hanno carica elettrica negativa.
| TABELLA 1: | PARTICELLE | SUBATOMICHE | ||
| particella | massa U.M.A. | massa assoluta | carica elem. | carica assoluta |
| protone | 1,0007 | 1,67 x 10-24 g | +1 | 1,6 x 10-19 C |
| neutrone | 1,009 | 1,67 x 10-24 g | 0 | 0 |
| elettrone | 5,9 x 10-4 | 9,11 x 10-28 g | -1 | 1,6 x 10-19 C |
Il nucleo atomico e' a sua volta costituito da due tipi di particelle: i PROTONI, con carica elettrica positiva, ed i NEUTRONI, privi di carica elettrica. La carica dell'elettrone e' uguale di intensita' ma opposta per il segno alla carica del protone (si veda la tabella 1).
Si definisce NUMERO ATOMICO, Z, il numero dei protoni presenti nel nucleo dell'atomo; poiche' ogni protone presenta carica elettrica elementare pari a +1, la carica positiva totale del nucleo e' pari a Z. Poiche' l'atomo e' elettricamente neutro, e poiche' l'elettrone ha carica elementare uguale al protone ma di segno opposto, Z e' anche il numero di elettroni dell'atomo neutro isolato.
Si definisce NUMERO DI MASSA, A, la somma del numero di protoni e neutroni dell'atomo. Poiche' la massa dell'elettrone e' trascurabile, A corrisponde approssimativamente alla massa dell'intero atomo espressa in Unita' di Massa Atomica (UMA; in precedenza questa unita' era chiamata Dalton).
Il numero di massa viene indicato in alto e a sinistra del simbolo atomico; il numero atomico in basso e a sinistra.
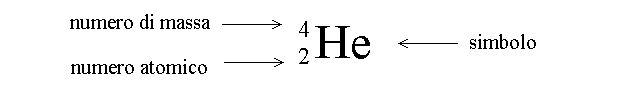
Se due nuclei hanno diverso valore di Z sono diversi e formano atomi diversi, con diverso nome. Se invece due nuclei hanno uguale valore di Z ma differiscono per il valore di A (cioe' hanno lo stesso numero di protoni ma differiscono per il numero di neutroni) essi formano atomi con caratteristiche chimiche uguali detti ISOTOPI (dal greco, stesso luogo, perche' occupano la stessa posizione nella tavola periodica). Ad esempio esistono tre varianti dell'idrogeno, il cui nucleo e' costituito rispettivamente da un protone (Z=1, A=1); un protone e un neutrone (deuterio, Z=1, A=2); un protone e due neutroni (trizio, Z=1, A=3): l'idrogeno comune (1H), il deuterio (2H) e il trizio (3H) sono i tre isotopi dell'idrogeno.
Definizione:: atomi dello stesso elemento (quindi con uguale valore di Z), che presentino un diverso numero di massa A sono definiti isotopi: gli isotopi hanno la stessa reattivita' chimica.
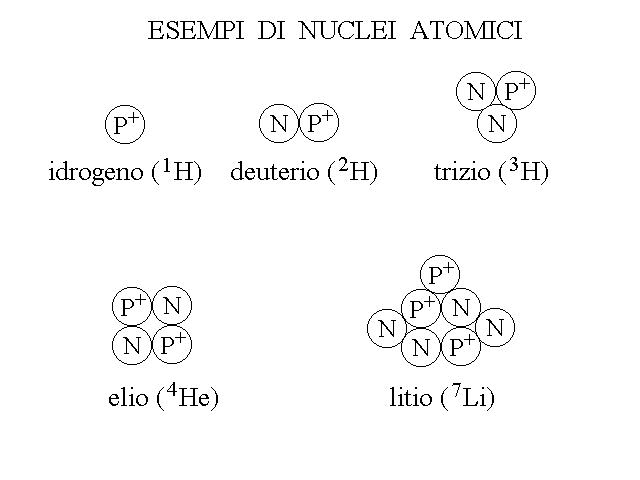
Figura 2: rappresentazione schematica di alcuni nuclei atomici
Per quanto piccolo, l'atomo ha una massa ed e' quindi attratto dai campi gravitazionali (cioe' ha un peso). La massa dell'atomo si esprime in unita' di massa atomica (UMA o Dalton) e corrisponde approssimativamente al numero di massa A. Una UMA e' definita come la dodicesima parte della massa dell'isotopo 12 del carbonio e non e' esattamente equivalente quindi ne' alla massa del protone ne' a quella del neutrone (si veda la tabella 1). Infatti una piccola frazione della massa atomica di ciascun nucleone e' convertita in energia di interazione forte nucleare e quindi i protoni di nuclei diversi non hanno esattamente la stessa massa. Questo non implica che i protoni di un atomo siano "diversi" da quelli di un altro: la perdita di massa si accompagna alle reazioni nucleari di fusione e fissione ed e' responsabile dell'energia atomica (delle centrali termonucleari e delle bombe atomiche).
A causa della presenza degli isotopi, la massa atomica non coincide con il numero di massa dell'atomo, anche volendo prescindere dal fatto che i nucleoni non hanno massa esattamente unitaria. La massa atomica media e' calcolata tenendo conto delle abbondanze relative degli isotopi e per questo le tavole riportano valori decimali (ad esempio il cloro ha peso atomico 35,45).
| Tabella 2: | ESEMPI DELLA ABBONDANZA ISOTOPICA RELATIVA | ||
| Elemento | abbondanza isotopica relativa | ||
| Idrogeno | 1H = 99,985% | 2H = 0,015% | 3H = trascurabile |
| Carbonio | 12C = 98,892% | 13C = 1,108% | 14C = trascurabile(*) |
| Ossigeno | 16O = 99,756% | 17O = 0,039% | 18O = 0,205% |
Nota (*): il 14C viene prodotto nell'atmosfera a seguito dell'irraggiamento dell'azoto con neutroni: 14N + neutrone --> 14C + 1H.
Il nucleo dell'atomo ruota sul suo asse: ha cioe' un movimento di 'spin'. Come tutte le cariche elettriche in movimento, anche il nucleo a causa del suo spin genera un campo elettromagnetico. In un corpo qualsiasi gli spin nucleari sono orientati in tutte le direzioni dello spazio (sono cioe' disordinati, ed il campo magnetico risultante e' nullo). Un campo elettromagnetico di opportuna intensita' puo' orientare nella stessa direzione gli spin di tutti i nuclei dell'oggetto che vi e' immesso e ordinarli. Questo processo assorbe energia dal campo.
Se un corpo viene introdotto in un campo magnetico adatto ad orientare gli spin nucleari questi si ordinano; e se la polarita' del campo viene improvvisamente invertita anche gli spin nucleari si riorientano. Il riorientamento di spin puo' essere seguito grazie all'assorbimento di energia del campo magnetico ed e' utilizzato in medicina per investigare la distribuzione spaziale dei nuclei atomici prescelti in una indagine diagnostica per immagini denominata TAC-RMN (Tomografia Assiale Computerizzata a Risonanza Magnetica Nucleare; spesso soltanto NMR o RMN).
Poiche' ogni nucleo risponde a valori precisi dell'energia del campo elettromagnetico, nella RMN e' possibile selezionare nuclei specifici. La RMN utilizzata per la diagnostica per immagini usa campi elettromagnetici che orientano lo spin del nucleo di idrogeno e quindi rivela soprattutto la distribuzione dell'acqua e dei grassi (ricchi di idrogeno).
Le particelle che compongono il nucleo possono andare incontro ad alcune trasformazioni, fenomeno definito RADIOATTIVITA'. Le piu' importanti reazioni nucleari sono le seguenti:
Si noti che: a) nelle reazioni si ha conservazione della carica: ad esempio la trasformazione del neutrone nella reazione 2 (carica=0) produce un protone (carica=+1) e un elettrone (carica=-1) la somma delle cui cariche e' uguale a quella del neutrone (+1-1=0); b) il decadimento del protone nella reazione 1 produce un positrone (elettrone positivo o antielettrone, un componente dell'antimateria, di norma non presente sulla Terra o nelle sue vicinanze). Per ragioni storiche, gli elettroni emessi dal nucleo nel corso dei fenomeni radioattivi sono chiamati radiazioni β (beta) e naturalmente esistono nelle due varieta' β+ e β-.
Un altro tipo di reazione nucleare che non comporta la trasformazione di una particella in un'altra e' l'emissione dal nucleo di una particella α (alfa), costituita da due neutroni e due protoni e pertanto uguale ad un nucleo di elio.
La radioattivita' e' legata a reazioni che avvengono nel nucleo dell'atomo e non ha nulla a che vedere con la reattivita' chimica, che interviene a livello degli elettroni piu' esterni.
Poiche' alcuni isotopi di alcuni atomi sono radioattivi mentre altri non lo sono, il termine radioattivita' e' erroneamente legato nel discorso comune a quello di isotopo, ma i termini 'isotopo' e 'radioattivo' non sono affatto sinonimi.
In natura esistono nuclei atomici stabili, detti freddi, e nuclei instabili, detti caldi. I nuclei caldi decadono spontaneamente emettendo radiazioni corpuscolate e si trasformano in nuclei diversi (cioe' con diverso valore di Z) detti nuclei figli. In genere all'emissione di una radiazione corpuscolata si associa anche quella di una radiazione elettromagnetica, non corpuscolata, detta radiazione γ (gamma; in realta' la radiazione γ appartiene alle frequenze tipiche dei raggi X ed ha la sola caratteristica distintiva di essere intensamente monocromatica).
La radioattivita' e' un fenomeno naturale che ha grande interesse per la medicina per due ragioni: in primo luogo gli elementi radioattivi ed i loro composti sono inquinanti ambientali dannosi per la salute dell'uomo e possono causare malattie; in secondo luogo elementi radioattivi possono essere impiegati per scopi diagnostici (nell'indagine chiamata scintigrafia; nella tomografia a emissione di positroni) e terapeutici.
MISURA DELLA RADIOATTIVITA'
L'unite' di misura della radioattivita' e' il Becquerel (Bq), corrispondente ad un evento di decadimento nucleare per secondo. Ogni isotopo radioattivo ha una sua specifica intensita' di radioattivita'; ad esempio 1g di radio ha una radioattivite' di 3,7 x 1010 Bq (ovvero il radio ha una radioattivite' specifica pari a 3,7 x 1010 Bq/g). In precedenza si utilizzava come unita' di misura della radioattivita' il Curie (cu), definito come la quantita' di radiazione emessa in 1 secondo da 1 g di radio (quindi 1 cu = 3,7 x 1010 Bq) e tale unita' e' ancora occasionalmente impiegata nella pratica.
CINETICA DEL DECADIMENTO RADIOATTIVO
Il numero di decadimenti radioattivi che si osserva in una unite' di tempo (min., sec., etc.) in un determinato campione e' funzione del numero di nuclei radioattivi in esso presenti. Poiche' ogni nucleo radioattivo ha la stessa probabilita' di decadere nell'unita' di tempo, e la quantita' dei nuclei radioattivi diminuisce nel tempo, anche la radioattivita' del campione diminuisce progressivamente nel tempo. Il risultato di questo processo e' una cinetica di tipo esponenziale, governata dalla legge:
dove At rappresenta la quantita' dell'isotopo radioattivo presente al tempo t, Ao la quantita' dello stesso isotopo all'inizio dell'esperimento (cioe' a t=0), e la base dei logaritmi naturali (e = 2,7188), k la costante cinetica caratteristica di quell'isotopo e t il tempo trascorso dall'inizio dell'esperimento.
Gli elettroni ruotano attorno al nucleo su orbite meno ben definite di quelle ipotizzate da Bohr.
In primo luogo non possiamo definire con precisione la posizione di ogni singolo elettrone e la sua velocita' (principio di indeterminazione di Heisenberg) perche' un corpuscolo delle dimensioni di un elettrone non puo' essere studiato senza sottoporlo a perturbazioni tali da alterarne o la posizione o la velocita'; in secondo luogo, a prescindere dalla precisione delle misure, gli elettroni si muovono all'interno di regioni tridimensionali dello spazio perinucleare, chiamate ORBITALI. Di fatto possiamo soltanto dire che attorno al nucleo esistono regioni dello spazio nelle quali c'e' elevata probabilita' di trovare l'elettrone.
IL DUALISMO ONDA-PARTICELLA. Come accade ad ogni carica elettrica in movimento, l'elettrone genera una radiazione elettromagnetica. La peculiarita' di una particella cosi' piccola, priva di riscontro nel mondo macroscopico che ci e' noto attraverso i sensi, e' che l'elettrone puo' a tratti comportarsi come se fosse soltanto un'onda elettromagnetica. Ad esempio un fascio di elettroni che passi attraverso due fessure da luogo a fenomeni di interferenza, caratteristici delle onde ma non delle particelle.
I NUMERI QUANTICI. I parametri che definiscono forma, posizione ed energia degli orbitali sono tre e sono chiamati NUMERI QUANTICI; un quarto numero quantico e' assegnato a ciascuno degli elettroni che abitano ciascuno degli orbitali.
Il NUMERO QUANTICO PRINCIPALE, n, assume soltanto valori interi uguali o superiori ad 1 e ai fini pratici il massimo valore di n e' 5: 6 > n > 0. Descrive il livello energetico principale, con buona approssimazione identificabile con le orbite di Bohr annotate con lo stesso simbolo. I livelli energetici hanno la forma di gusci sferici cavi e concentrici, aventi come centro il nucleo dell'atomo.

Figura 3: I gusci o livelli elettronici: sfere cave concentriche disposte attorno al nucleo.
La natura quantistica dei livelli elettronici si riflette primariamente nel fatto che essi sono indicati da un numero quantico principale intero: esistono un livello con n=1 e uno con n=2 ma non esiste un livello con n=1,5.
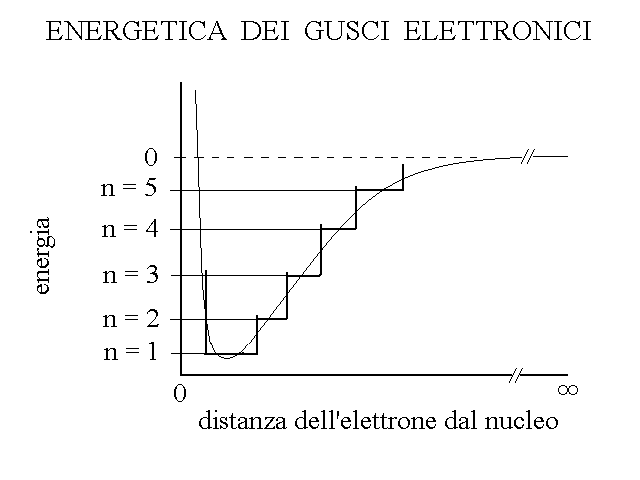
Figura 4: Natura discontinua, a salti o a gradini dell'energia associata ai vari livelli elettronici.
Come si vede dalla figura, livelli energetici individuati dai numeri quantici principali (e anche dai secondari) sono discreti (quantistici) come i gradini di una scala (linee spesse) e non continui (linea sottile).
Il NUMERO QUANTICO SECONDARIO, l (elle), descrive il sottolivello al quale appartiene l'orbitale considerato e in pratica ne definisce la forma: infatti se gli orbitali dello stesso livello avessero tutti la stessa forma si sovrapporrebbero e finirebbero per coincidere. Il numero quantico secondario puo' assumere tutti i valori interi compresi tra 0 e n-1; pertanto al primo livello energetico compete un solo tipo di orbitale contraddistinto dai numeri quantici n=1 e l=0; al secondo livello competono due tipi di orbitali con n=2, l=0 e n=2, l=1 e cosi' via.
L'orbitale atomico con l=0 ha la forma di una sfera cava e viene chiamato orbitale s; quello con l=1 ha la forma di una clessidra (orbitale p); quello con l=2 ha forme piu' complesse (in genere di quadrifoglio; orbitale d); etc.
Il NUMERO QUANTICO MAGNETICO, m, descrive l'orientamento dell'orbitale considerato nello spazio e puo' assumere il valore dei numeri interi positivi e negativi compresi tra -l e +l. Consegue che ogni livello ospita un solo orbitale s (con l=0 e m=0), ogni livello superiore al primo ospita anche tre orbitali p denominati px, py e pz ed orientati ad angolo retto ciascuno rispetto agli altri due (l=1, m=-1; l=1, m=0; l=1, m=+1), etc.
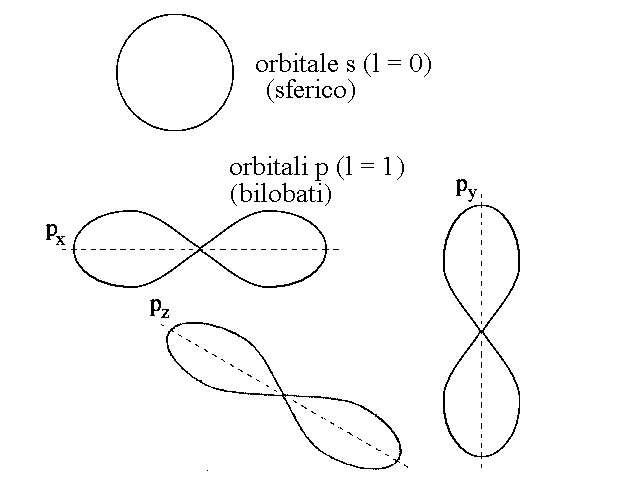
Figura 5: Forma e orientamento degli orbitali s e p.
| principale (n) | secondario (l) | magnetico (m) | orbitali |
| 1 | 0 | 0 | 1s |
| 2 | 0 | 0 | 2s |
| 2 | 1 | +1 0 -1 | 2px 2py 2pz |
| 3 | 0 | 0 | 3s |
| 3 | 1 | +1 0 -1 | 3px 3py 3pz |
| 3 | 2 | +2 +1 0 -1 -2 | 5 orbitali 3d |
Il quarto numero quantico (NUMERO QUANTICO DI SPIN) e' applicato all'elettrone anziche' all'orbitale e ne descrive il verso di rotazione sul proprio asse; puo' assumere soltanto due valori, +1/2 e -1/2. Gli elettroni possono essere presenti nel numero massimo di due per ciascun orbitale e questo comporta che il primo livello puo' contenere un massimo di due elettroni (nell'orbitale 1s), il secondo un massimo di otto (negli orbitali 2s, 2px, 2py e 2pz), etc. Se un orbitale contiene un solo elettrone questo puo' assumere indifferentemente spin=+1/2 o spin=-1/2; se invece un orbitale contiene due elettroni questi devono avere numero di spin opposto e non possono avere entrambi lo stesso numero di spin. Questa e' una conseguenza del principio di esclusione, scoperto dal fisico W. Pauli (PRINCIPIO DI PAULI), secondo il quale nello stesso atomo non possono esistere due elettroni che condividono tutti e quattro i numeri quantici.
SUSCETTIBILITA' MAGNETICA. La suscettibilita' magnetica di un atomo isolato o presente in una molecola dipende dal fatto che questo abbia o meno elettroni spaiati (cioe' che si trovano da soli in un orbitale). Magnetizzare un atomo significa infatti orientare nello stesso verso lo spin dei suoi elettroni spaiati, mediante un campo magnetico di intensita' adeguata; per contro nessun campo magnetico puo' orientare nello stesso verso lo spin di due elettroni che si trovino nello stesso orbitale, perche' questo violerebbe il principio di Pauli. Una sostanza che contiene atomi con elettroni spaiati, ed e' quindi magnetizzabile, si definisce paramagnetica o ferromagnetica; ne sono esempi i metalli (ad es. il ferro, magnetizzando il quale si possono produrre le calamite e gli aghi delle bussole). Una sostanza che non contiene elettroni spaiati si definisce diamagnetica e non e' magnetizzabile; molti composti organici hanno questa caratteristica, come pure la stragrande maggioranza delle molecole presenti negli organismi viventi. Per questa ragione l'organismo non risente dei campi magnetici.
La carica positiva del nucleo genera un campo elettrostatico che attrae e trattiene gli elettroni e che e' in ogni punto dello spazio tanto piu' forte quanto piu' il punto considerato e' vicino al nucleo. Poiche' pero' il campo e' quantizzato l'intensita' decresce in modo discontinuo (a "salti" o a gradini, come illustrato nella fig. 4) quando ci si allontana dal nucleo. Se noi immaginiamo di far progressivamente avvicinare un elettrone ad un nucleo isolato, ad esempio di idrogeno, ci aspettiamo di osservare quanto segue: quando l'elettrone si trova a distanza infinita dal nucleo la forza attrattiva di natura elettrostatica e' nulla (cioe' l'energia del campo a distanza infinita dal nucleo e' uguale a zero); man mano che l'elettrone si avvicina viene attratto verso il nucleo e forzato ad avvicinarsi sempre piu'; in questo processo viene emessa energia. Quando l'elettrone entra nell'area dello spazio corrispondente al guscio elettronico individuabile piu' distante (supponiamo il n.5, tanto per dare un numero) viene emesso un quanto di energia (in genere sotto forma di radiazione elettromagnetica) e l'elettrone risulta effettivamente prigioniero di quel livello: puo' uscire e ritornare a distanza infinita dal nucleo solo se dall'esterno gli viene fornita energia. Dal livello n.5 l'elettrone puo' cadere nel n.4, di nuovo con emissione di energia; quando questo accade risulta legato piu' fortemente ed e' necessaria piu' energia per estrarlo. Di livello in livello l'elettrone finira' per cadere nell'area dello spazio corrispondente al numero quantico 1, la piu' vicina al nucleo. Questo rappresenta il piu' basso livello di energia potenziale accessibile e di conseguenza il piu' stabile, quello dal quale la fuoriuscita richiede la piu' alta energia esterna; l'elettrone si fermera' qui.
Il processo descritto e' analogo a quello che avverrebbe, a livello macroscopico, ad una palla che venisse lasciata cadere sulle scale della cantina: la palla rimbalzando di gradino in gradino scende i livelli energetici del campo gravitazionale fino a raggiungere il pavimento della cantina, il livello piu' basso accessibile, dove si ferma. Chiariamo alcuni termini del paragone. 1) Il campo gravitazionale, sulle dimensioni della scala della cantina, e' continuo e la discontinuita' e' artificialmente introdotta dagli scalini: infatti la palla puo' fermarsi soltanto su uno scalino o sul successivo ma non a meta' strada tra i due; invece il campo elettrico nucleare, alla scala delle dimensioni atomiche e' intrinsecamente discontinuo. 2) L'energia della palla e' energia potenziale di natura gravitazionale e viene perduta sotto forma di energia cinetica e termica (la palla rimbalzando si riscalda); mentre l'energia potenziale dell'elettrone nel campo nucleare e' di natura elettrostatica. 3) Il livello di energia potenziale uguale a zero e' definito a distanza infinita dal nucleo nel caso dell'elettrone e a livello del mare per la palla; in entrambi i casi l'energia finale del sistema risulta inferiore a questo livello. Infatti l'elettrone si trova in regioni del campo dove e' intensamente attratto e la palla al di sotto del livello di riferimento (sul pavimento della cantina). Per questo motivo l'energia finale del sistema e' definita come negativa, e si vuole indicare con questo soltanto che riportare il sistema al livello di riferimento (distanza infinita o livello del mare) richiede che sia fornita energia dall'ambiente.
Da quanto e' stato detto sul nucleo e sugli orbitali si possono dedurre alcune regole generali che permettono di predire o spiegare la struttura degli atomi.
In primo luogo osserviamo che il numero atomico e' intero e compreso tra 1 e 92 (non c'e' una vera ragione teorica per il limite superiore, se non che i nuclei molto grandi diventano instabili). Poiche' l'atomo e' neutro, il numero dei suoi elettroni corrisponde al numero atomico Z.
Per costruire la configurazione elettronica di un atomo qualsiasi, scelto o dato un qualunque valore di Z, occorre immaginare la disposizione degli Z elettroni negli orbitali, avendo cura di riempire per primi i livelli energetici piu' bassi. Si comincia quindi con il disporre gli elettroni nell'orbitale 1s (n=1, l=0, m=0). Se gli elettroni sono piu' di due il livello n=1 risultera' completo e si dovranno pertanto disporre gli elettroni nel livello successivo (n=2) a partire dall'orbitale 2s (l=0, m=0) per proseguire poi con i 2p (l=1, m=-1, 0, +1), e cosi' via rispettando l'ordine indicato nella figura seguente:
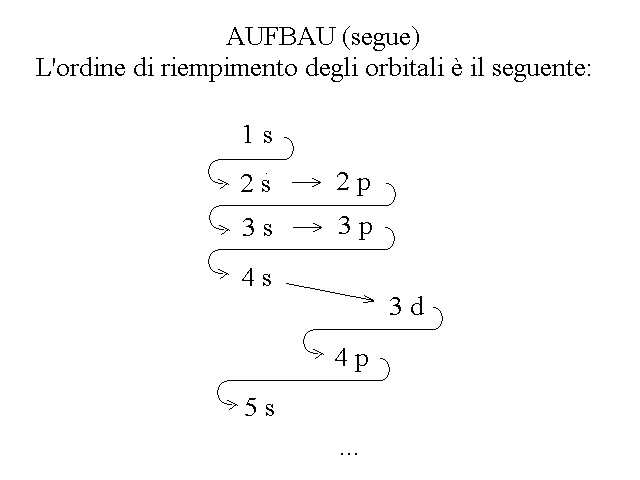
Figura 6: L'ordine di riempimento degli orbitali atomici rispetta le relative energie, dalla minore alla maggiore.
| Elemento | A | Z | Protoni | 1s | 2s | 2px | 2py | 2pz |
| idrogeno | 1 | 1 | 1 | 1 | - | - | - | - |
| elio | 4 | 2 | 2 | 2 | - | - | - | - |
| litio | 7 | 3 | 3 | 2 | 1 | - | - | - |
| berillio | 9 | 4 | 4 | 2 | 2 | - | - | - |
| boro | 11 | 5 | 5 | 2 | 2 | 1 | - | - |
| carbonio | 12 | 6 | 6 | 2 | 2 | 1 | 1 | - |
| azoto | 14 | 7 | 7 | 2 | 2 | 1 | 1 | 1 |
| ossigeno | 16 | 8 | 8 | 2 | 2 | 2 | 1 | 1 |
| fluoro | 19 | 9 | 9 | 2 | 2 | 2 | 2 | 1 |
| neon | 20 | 10 | 10 | 2 | 2 | 2 | 2 | 2 |
Si definisce configurazione elettronica di un atomo l'elenco dei suoi elettroni suddivisi nei vari orbitali. Ad esempio dalla tabella 2 possiamo ricavare che la configurazione elettronica del carbonio e' 1s2,2s2,2p2 formula che ci indica la presenza di 2 elettroni nell'orbitale 1s, 2 nell'orbitale 2s e 2, complessivamente e comunque disposti, nei tre orbitali 2p
Date le regole dell'aufbau, possiamo fare la seguente osservazione: la configurazione elettronica esterna (cioe' relativa all'ultimo livello occupato) e' destinata a ripetersi in atomi diversi, seppure per valori di n diversi. Ad esempio la configurazione elettronica esterna dell'azoto e' 2s2,2p3 (configurazione completa: 1s2,2s2,2p3 per Z=7 e 7 elettroni) e quella del fosforo e' 3s2,3p3 (configurazione completa: 1s2,2s2,2p6,3s2,3p3 per Z=15 e 15 elettroni).
E' importante osservare l'anomalia per la quale gli orbitali d di ciascun livello che li possiede risultano a maggiore energia dell'orbitale s del livello seguente, e quindi vengono riempiti successivamente
La forma degli orbitali e' stata descritta in precedenza e una rappresentazione grafica e' riportata nella figura 7.
Orbitali atomici, in genere appartenenti allo stesso livello energetico (cioe' contraddistinti dallo stesso numero quantico principale n), e che presentino una parziale sovrapposizione spaziale possono fondersi tra loro generando orbitali atomici ibridi. Gli orbitali ibridi si formano sempre nello stesso numero degli orbitali atomici che concorrono alla loro formazione: cioe' l'ibridazione non cambia il numero totale degli orbitali dell'atomo. Ad esempio l'ibridazione dell'orbitale 2s con i tre orbitali 2p produce i quattro orbitali ibridi sp3 riportati nella figura qui sotto, l'ibridazione dell'orbitale 2s con due soli orbitali 2p produce i tre orbitali ibridi sp2 e l'ibridazione dell'orbitale 2s con un solo orbitale 2p produce i due orbitali ibridi sp.
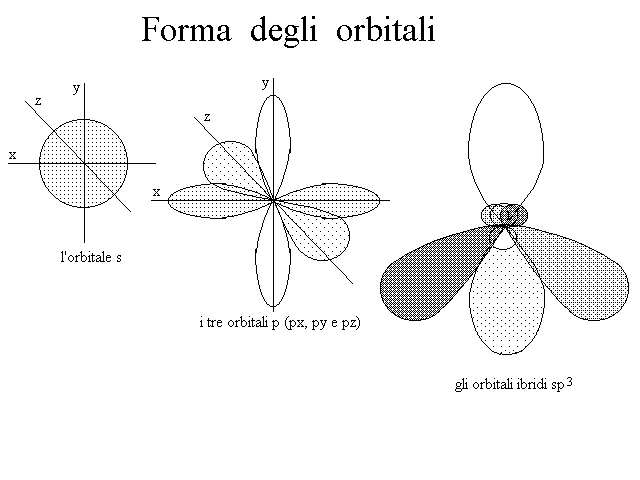
Figura 7: Forme degli orbitali atomici non ibridizzati s e p e degli orbitali ibridi sp3
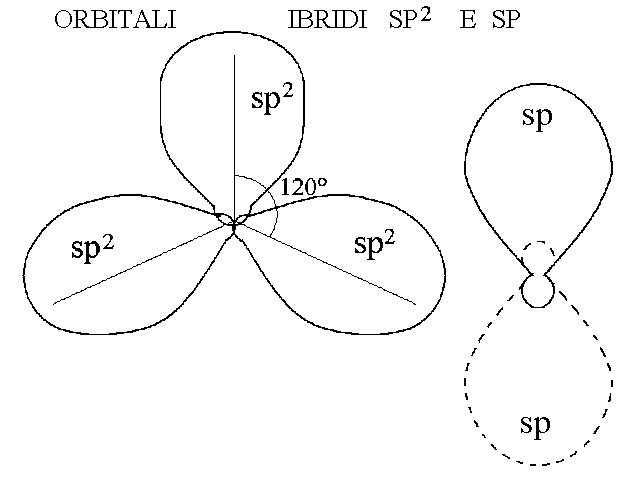
Figura 8: Forme degli orbitali ibridi sp2 e sp.
Un modello divertente degli orbitali ibridi (ad es. sp3) puo' essere ottenuto legando tra loro un numero sufficiente di palloncini. C'e' una buona ragione per la quale i palloncini si dispongono come gli orbitali ibridi: i palloncini si dispongono in modo da minimizzare la reciproca deformazione e quindi si allontanano il piu' possibile gli uni dagli altri. Anche gli orbitali ibridi si dispongono in modo da minimizzare la loro sovrapposizione, a causa della repulsione reciproca tra gli elettroni in essi contenuti.

Figura 9: Quattro palloncini legati tra loro assumono la stessa conformazione spaziale tetraedrica degli orbitali ibridi sp3.
La geometria degli orbitali ibridi e' la seguente: i quattro orbitali ibridi sp3 puntano verso i quattro vertici di un immaginario tetraedro (piramide a base triangolare) del quale il nucleo atomico occupa il centro. L'angolo formato tra due qualsiasi orbitali ibridi sp3 e avente come vertice il nucleo misura 109,5°. I tre orbitali ibridi sp2 giacciono su un unico piano e puntano verso i vertici di un triangolo equilatero del quale il nucleo dell'atomo occupa il centro, formando angoli di 120°; i due lobi dell'orbitale p non ibridizzato puntano al di sopra e al di sotto del piano occupato dagli orbitali sp2 e formano con questo un angolo retto. I due orbitali ibridi sp giacciono su una linea e puntano quindi in direzioni opposte (180°), i due orbitali p non ibridizzati puntano ad angolo retto l'uno dall'altro e dalla linea sulla quale giacciono i due orbitali sp.
L'energia dell'orbitale s e' inferiore a quella degli orbitali p dello stesso livello (cioe' s e p sono due sottolivelli diversi); l'energia degli orbitali ibridi e' la media di quelle degli orbitali che li hanno formati e quindi risulta intermedia tra quelle degli orbitali s e p, come si vede nella seguente figura (per la configurazione elettronica esterna 2s2, 2p2 del carbonio).
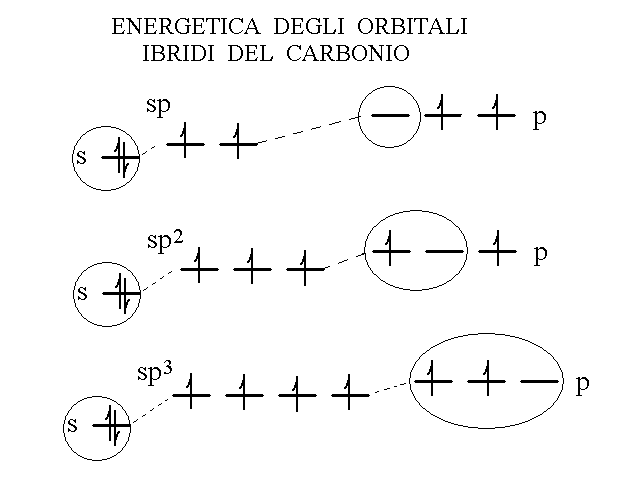
Fig.10: energetica degli orbitali ibridi.
I fenomeni di ibridazione degli orbitali esterni del carbonio e dell'azoto sono particolarmente importanti per la biochimica e quindi per la medicina perche' sono responsabili della forma delle molecole organiche.
Se un atomo perde un elettrone, la carica positiva dei protoni del nucleo non e' piu' esattamente bilanciata da quelle negative degli elettroni e si ottiene uno ione positivo o catione, con carica netta pari a +1. La perdita di un ulteriore elettrone porta alla formazione di uno ione positivo con carica elettrica netta pari a +2 e cosi' di seguito. E' inoltre possibile che un atomo isolato catturi un elettrone perduto da un altro atomo e venga cosi' ad acquisire una carica elettrica negativa pari a -1: si ha in questo caso la formazione di uno ione negativo o anione.
Il nome di ione (dal greco, viaggiatore) indica quindi un atomo o un gruppo di atomi (vedi oltre) che presenta stabilmente una carica elettrica netta diversa da zero e, a causa di questa si muove (viaggia) in un campo elettrico, verso il polo positivo o verso quello negativo (fenomeno dell'elettroforesi o trasporto elettrico). La struttura degli ioni poliatomici sara' trattata meglio piu' avanti, insieme con quella delle molecole.
Sebbene in linea di principio qualunque atomo possa formare molti ioni positivi e negativi con diversa carica, in pratica ogni atomo forma soltanto uno o pochi ioni stabili. Ad esempio il sodio forma soltanto il catione monopositivo Na+; il calcio soltanto il catione bipositivo Ca+2; il fluoro ed il cloro soltanto gli anioni mononegativi F- e Cl-; e cosi' via.
Le configurazioni elettroniche esterne degli ioni nominati sopra corrispondono al completo riempimento del livello elettronico esterno: ad esempio l'atomo di sodio (Na) presenta la configurazione elettronica 1s2, 2s2 2p6 3s1; lo ione Na+, avendo perduto un elettrone, ha la 1s2, 2s2 2p6 e presenta quindi il livello elettronico esterno (con n=2) completo. Gli ioni O-2 e F- presentano entrambi la stessa configurazione elettronica esterna completa 1s2, 2s2 2p6.
Poiche' le configurazioni elettroniche esterne complete caratterizzano gli elementi che appartengono al gruppo dei gas nobili (He, Ne, etc; si veda piu' avanti, la lezione sulla tavola periodica), si dice che i cationi stabili sono formati da elementi che hanno perduto tanti elettroni quanti era necessario per assumere la configurazione elettronica esterna del gas nobile che li precede (per numero atomico), mentre gli anioni ne hanno acquistati quanti erano necessari a formare la configurazione del gas nobile che li segue (per numero atomico).
ENERGIA DI IONIZZAZIONE. Si definisce energia di ionizzazione (Ei) la quantita' di energia che e' necessario fornire ad un atomo neutro isolato in fase gassosa per estrarne un elettrone. In genere l'energia sara' fornita da radiazioni o sotto forma di calore. Si hanno le energie di prima ionizzazione (per estrarre un elettrone da un atomo neutro), di seconda ionizzazione (per estrarre un elettrone da uno ione monopositivo e convertirlo nel corrispondente ione bipositivo) e cosi' di seguito. Ad esempio:
Ca + Ei1 --> Ca+ + e-
Ca+ + Ei2 --> Ca+2 + e-
AFFINITA' ELETTRONICA. Quando un atomo isolato in fase gassosa incontra un elettrone puo' accadere che lo catturi e lo ospiti in uno dei suoi orbitali (in questa definizione non ha interesse in che modo l'elettrone isolato sia stato prodotto: gli elettroni isolati non si trovano spontaneamente in natura a meno che non siano stati prima strappati ad atomi neutri o emessi nel corso di un decadimento radioattivo). Perche' questo fenomeno possa avvenire occorre che l'atomo possieda un orbitale vuoto o occupato da un solo elettrone: ad esempio la configurazione elettronica dell'atomo di fluoro e' 1s2, 2s2 2p5 ed e' presente quindi un orbitale 2p occupato da un solo elettrone; a seguito della cattura di un elettrone il fluoro si trasforma in uno ione mononegativo:
F + e- --> F- + AE
L'energia emessa nel processo di cattura dell'elettrone si chiama affinita' elettronica (AE).
Il neon (Ne) presenta la configurazione elettronica 1s2, 2s2 2p6, con il livello esterno completo, e pertanto costituisce un esempio di un atomo che non ha tendenza a catturare elettroni.
L'ELETTRONEGATIVITA'. Come l'atomo neutro ha tendenza a catturare un elettrone libero con il quale venga a a scontrarsi, cosi' la cattura dell'elettrone avviene anche all'interno del legame chimico. In questo caso pero' l'elettrone non e' libero ma e' legato ad un altro atomo, e la tendenza ad attrare gli elettroni di legame non e' definita affinita' elettronica ma elettronegativita'. Questo concetto sara' definito piu' accuratamente nel capitolo sui legami chimici.
Nella discussione sulla radioattivita' sono stati descritti alcuni tipi di radiazioni corpuscolate, formate da fasci di particelle (elettroni, nuclei di elio). Esiste pero' un altro tipo di radiazioni formate da campi di energia elettromagnetica pulsanti (cioe' di intensita' periodicamente variabile) che si propagano nello spazio: le RADIAZIONI ELETTROMAGNETICHE.
Le radiazioni elettromagnetiche si propagano in linea retta, anche nel vuoto, ed hanno la capacita' di orientare gli elettroni di un eventuale corpo di sostanza paramagnetica che si trovi in prossimita' del percorso della radiazione. Sono quindi rivelabili mediante antenne, oggetti metallici familiari a tutti, il movimento dei cui elettroni e' esponsabile della trasmissione dei segnali elettromagnetici. Per converso, ogni carica elettrica che si muova nello spazio genera una radiazione elettromagnetica.
Il campo elettromagnetico associato ad una radiazione non e' costante ma ha natura ondulatoria ed i vettori elettrico e magnetico si invertono periodicamente nel tempo, con andamento sinusoidale: per questo si parla di "onde elettromagnetiche".
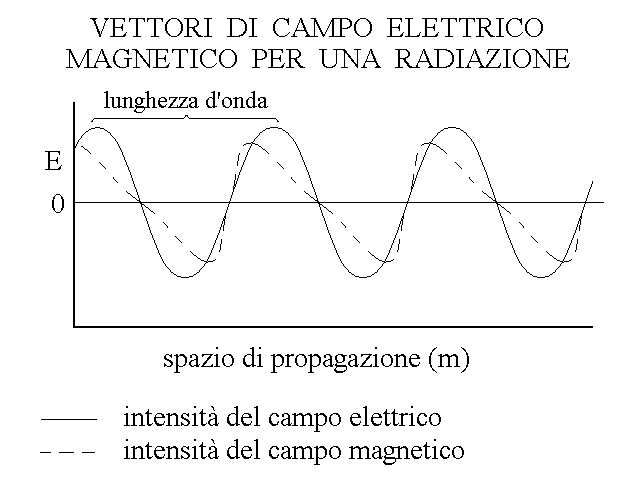
Fig.11
Si definisce lunghezza d'onda (λ - greco lambda) lo spazio percorso dalla radiazione tra due punti successivi nei quali il vettore elettrico e quello magnetico assumono lo stesso valore e la stessa fase (cioe' sono o ascendenti o discendenti), e frequenza (ν - greco ni) il numero di cicli del campo nell'unita' di tempo di 1 secondo. Il prodotto della lunghezza d'onda per la frequenza e' pari alla velocita' di propagazione della radiazione (c), secondo la relazione:
Einstein dimostro' che la velocita' di propagazione delle radiazioni elettromagnetiche nel vuoto e' una costante assoluta della naura e che non puo' essere superata da nessun altro evento in movimento; il suo valore e' pari a circa 300.000 km/s.
Una radiazione elttromagnetica composta da onde aventi tutte la stessa frequenza e' definita "monocromatica". Alcuni eventi producono radiazioni di questo tipo: ad esempio i raggi gamma prodotti dal decadimento radioattivo e le radiazioni luminose prodotte dai laser. Alcuni laser a stato solido emettono radiazioni che sono non soltanto monocromatiche, ma anche in concordanza di fase: cioe' tutta l'energia emessa e' concentrata in onde della stessa frequenza e i cui massimi e minimi cadono negli stessi punti dello spazio.
Le radiazioni magnetiche piu' comuni pero' non sono monocromatiche ma sono formate da fasci di onde aventi frequenze diverse mescolate insieme: ad esempio la luce solare o la luce delle lampade ad incandescenza. Molti cristalli hanno la capacita' di deviare in misura diversa le diverse frequenze di una radiazione e separano pertanto la luce bianca nelle sue diverse componenti cromatiche, come accade quando si forma l'arcobaleno o quando si fa riflettere la luce della lampada sulle tracce di un comune CD.
Poiche' una radiazione elettromagnetica ordinaria risulta dal mescolamento di onde che si propagano insieme ma hanno energia (frequenza) diversa, separabili mediante cristalli, e' possibile indagarne lo spettro, cioe' misurare l'intensita' (cioe' la quantita' di energia) associata a ciascuna frequenza. Come vedremo piu' avanti l'energia delle radiazioni elettromagnetiche e' anch'essa quantizzata in unita' discrete definite fotoni o quanti di luce e la quantita' di energia e' pertanto proporzionale al numero di fotoni per ciascuna lunghezza d'onda.
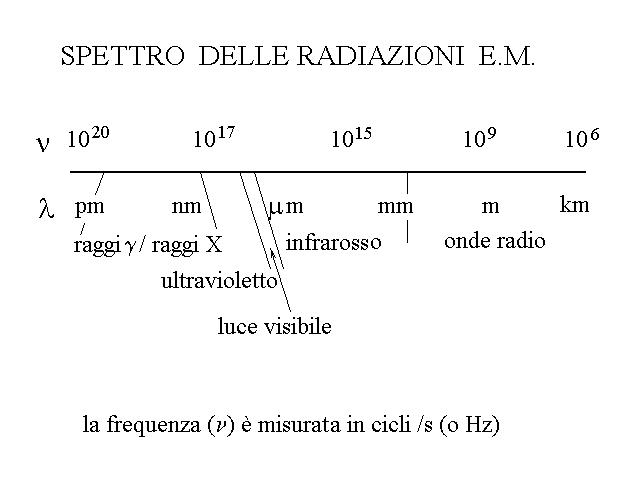
Fig.12: lo spettro delle radiazioni elettromagnetiche.
Come si vede dalla figura, sono radiazioni elettromagnetiche i raggi X, la luce ultravioletta e quella visibile, l'infrarosso e le onde radio-televisive. Queste radiazioni hanno proprieta' molto diverse (alcune delle quali rilevanti per la medicina) che si rivelano nella loro interazione con la materia. Spesso per semplicita' ci si riferisce alle radiazioni elettromagnetiche come "luce" e si parla non solo di luce visibile ma anche, impropriamente, di luce ultravioletta o di luce di sincrotrone (raggi X); ma il termine luce dovrebbe essere riservato alle radiazioni che compongono lo spettro del visibile (con lunghezze d'onda comprese all'incirca tra 400 e 700 nm).
IL FOTONE O QUANTO DI LUCE. La radiazione elettromagnetica non e' continua ma quantistica e la sua quantita' minima e' il fotone o quanto elettromagnetico, vero e proprio "pacchetto" di energia. In senso proprio il fotone non ha una massa, ma l'equazione di Einstein:
E = m c2
consente di calcolare la massa equivalente alla sua energia. Una brillante dimostrazione dell'equivalenza tra massa ed energia deriva dall'osservazione che la direzione di propagazione delle radiazioni elettromagnetiche e' deviata dai campi gravitazionali.
L'energia di un fotone dipende dalla frequenza della radiazione secondo l'equazione di Plank:
E = h ν
La definizione del quanto di luce ci permette di chiarire meglio il significato dell'intensita' di energia delle radiazioni elettromagnetiche, che risulta dal prodotto del flusso di fotoni nell'unita' di tempo per l'energia di ciascun fotone. Ad esempio due radiazioni monocromatiche delle quali la prima abbia frequenza doppia della seconda possono avere la stessa intensita' se la seconda contiene il doppio dei fotoni della prima.
Quando una radiazione elettromagnetica o corpuscolata colpisce un corpo si osservano reazioni caratteristiche, che dipendono principalmente dall'energia della radiazione.
Le radiazioni α, β e γ (prodotte dai fenomeni radioattivi) e le radiazioni elettromagnetiche X sono in grado di strappare (o in alcuni casi di aggiungere) elettroni agli atomi con cui interagiscono, trasformandoli in ioni; sono pertanto dette readiazioni ionizzanti. Il meccanismo attraverso il quale questo fenomeno avviene e' diverso a seconda del tipo di radiazione considerata:
1) La particella α, che e' uguale ad un nucleo di He estrae 2 elettroni dall'atomo con cui entra in contatto e si lascia dietro uno ione bipositivo.
2) La particella β+ all'incontro con un elettrone lo distrugge e si distrugge (processo di annichilazione); la massa delle due particelle viene convertita in energia secondo la relazione E=mc2 e si assiste pertanto all'emissione di una intensa radiazione elettromagnetica di tipo gamma. L'atomo che e' stato colpito dalla particella perde un elettrone e si converte in uno ione monopositivo.
3) La particella β- e' un elettrone e quando ha perduto nei vari urti cui va incontro la sua energia cinetica iniziale, puo' essere catturato da un atomo idoneo che si trasforma in uno ione mononegativo.
4) Le radiazioni γ e la radiazione X sono sostanzialmente identiche (la differenza essendo che le prime sono fortemente monocromatiche mentre la seconda presenta in genere uno spettro di lunghezze d'onda diverse) e sono esclusivamente elettromagnetiche. Se incontrano un elettrone di un atomo gli cedono energa sufficiente per estrarlo dall'orbitale in cui si trova e allontanarlo; quindi producono ioni monopositivi.
Nel caso in cui i fenomeni descritti ai precedenti punti 1,2 e 4 avvengano a carico di elettroni situati in orbitali di legame anziche' in orbitali atomici, in aggiunta alla ionizzazione si ha anche la rottura delle molecole colpite, e in molti casi la produzione di radicali (cioe' di specie chimiche contenenti un elettrone spaiato).
5) Le radiazioni ultraviolette (UV) e visibili non forniscono energia sufficiente per estrarre gli elettroni dagli atomi o dalle molecole e formare quindi ioni (radiazioni non ionizzanti). Possiedono pero' energia sufficiente per spostare un elettrone dall'orbitale in cui si trova ad uno di livello superiore (purche' quest'ultimo non sia gia' occupato da una coppia di elettroni). Questo fenomeno si chiama salto quantico. Lo stato di un atomo riempito secondo l'aufbau e quindi con gli orbitali piu' interni completamente riempiti si chiama stato fondamentale; quello nel quale e' presente una lacuna in un orbitale interno e un elettrone in un orbitale esterno stato eccitato. Ad esempio un fotone di lunghezza d'onda opportuna puo' spostare l'elettrone dell'idrogeno dallo stato fondamentale 1s1 allo stato eccitato 1s0, 2s1. Lo stato eccitato cosi' prodotto in un atomo o in una molecola tende a decadere nello stato fondamentale con emissione di energia sotto forma di radiazione luminosa (fluorescenza o fosforescenza) o di calore. Le radiazioni visibili hanno energia cosi' bassa che possono promuovere transizioni elettroniche soltanto in molecole complesse, che presentino orbitali (di legame; vedi oltre) con minime differenze energetiche.
6) Le radiazioni infrarosse (IR) e le microonde non hanno energia sufficiente per promuovere il salto quantico degli elettroni neppure in molecole complesse, con livelli energetici ravvicinati. Interagiscono con la materia aumentando la frequenza e l'ampiezza dei movimenti rotazionali e vibrazionali degli atomi e delle molecole e in pratica ne causano il riscaldamento (forni a IR e a microonde).
7) Le onde radio hanno energie troppo basse per causare significativi effetti termici ma sono in grado di far muovere gli elettroni all'interno di conduttori (come avviene nelle antenne radio-TV).
Tutti i fenomeni descritti sopra avvengono perche' un elettrone o un atomo o una molecola e' colpito da un fotone dell'energia appropriata. Non e' possibile, in genere, ottenere lo stesso effetto con un maggior numero di fotoni a minore energia. Infatti un fotone X o γ puo' colpire un elettrone e fornirgli l'energia di prima ionizzazione, allontanandolo dall'atomo a cui e' legato, ma due fotoni ciascuno con la meta' dell'energia del primo non possono colpire simultaneamente un elettrone e fornirgli cumulativamente l'energia necessaria alla ionizzazione.
Esiste un solo caso in cui e' possibile ottenere effetti "a due fotoni": se un atomo o una molecola possiede uno stato eccitato raggiungibile con un fotone UV, puo' darsi che un secondo fotone UV che colpisca lo stato eccitato prima che questo abbia avuto il tempo di decadere causi la ionizzazione. In questo caso nessuno dei due fotoni UV aveva energia sufficiente a causare la ionizzazione dello stato fondamentale, ma il primo aveva energia sufficiente per popolare lo stato eccitato (che ha un elettrone in un orbitale a bassa energia, lontano dal nucleo) ed il secondo aveva energia sufficiente per causare la ionizzazione dello stato eccitato.
A conclusione di questa disamina possiamo chiederci che cosa significa "vedere" un oggetto e se esistano oggetti che non possiamo "vedere". Quando un oggetto di dimensioni macroscopiche viene illuminato esso riflette alcune delle radiazioni che lo colpiscono e ne trattiene altre. Se la costituzione elettronica dell'oggetto e' tale da poter interagire con alcune delle radiazioni che lo colpiscono, queste saranno assorbite mentre le altre saranno riflesse e l'oggetto apparira' colorato del colore corrispondente alle radiazioni riflesse. Ad esempio un pezzo di legno verniciato di rosso e illuminato con luce bianca riflette le radiazioni di lunghezza d'onda corrispondente al rosso e assorbe quelle corrispondenti al verde e al blu (che interagiscono con i suoi elettroni e popolano stati eccitati della sostanza usata come vernice). Il nostro occhio viene colpito dalle radiazioni riflesse dall'oggetto che eccitano una sostanza presente nella retina (il retinale, legato alla proteina "opsina"). Lo stato eccitato del retinale si distacca dall'opsina e questo fenomeno genera il segnale nervoso che noi chiamiamo visione.
A prescindere dal problema della dimensione dell'oggetto visibile, che deve essere tale da rientrare nel potere risolutore del nostro occhio (o del nostro microscopio), e' evidente che perche' un materiale sia "visibile", questo deve possedere degli elettroni disposti in orbitali di stato fondamentale che possano essere eccitati dalla radiazione elettromagnetica. Non e' possibile "vedere" un nucleo atomico (che pero' puo' essere rivelato con altri mezzi come la RMN) o un elettrone isolato.
EFFETTI BIOLOGICI DELLE RADIAZIONI IONIZZANTI. Le radiazioni ionizzanti hanno effetti in genere dannosi anche sulla materia che costituisce i tessuti biologici, descrivere i quali pero' richiede una conoscenza abbastanza dettagliata della struttura delle macromolecole biologiche. Anche le radiazioni non ionizzanti possono interagire con la materia che costituisce i tessuti dell'organismo, in alcuni casi senza effetti deleteri (un esempio e' dato dai fenomeni della visione).
L'aufbau e' un processo periodico perche' la struttura degli orbitali nei vari gusci elettronici si ripete: ad esempio l'idrogeno presenta la configurazione elettronica esterna 1s1, il litio la 2s1, il sodio la 3s1 ed il potassio la 4s1. Quando due elementi hanno in comune la configurazione elettronica esterna, seppure con diverso numero quantico principale, essi presentano comportamento chimico simile; ad esempio i quattro elementi sopra riportati formano tutti uno solo tipo di ione stabile con carica netta +1.
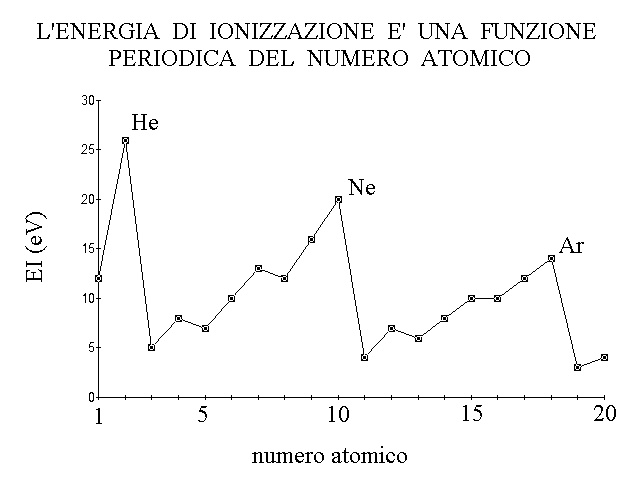
Figura 13: L'energia di ionizzazione e' un esempio di proprieta' dell'atomo che presenta un andamento periodico rispetto al numero atomico.
Ordinando gli elementi per numero atomico crescente si puo' costruire una tabella nella quale la posizione dell'elemento da informazioni sulla sua configurazione elettronica esterna e, di conseguenza, sulle sue proprieta' chimiche.

Figura 14: La tavola periodica degli elementi.
I PERIODI. La tavola periodica degli elementi presenta sette righe orizzontali, piu' o meno complete, dette periodi. Ciascuna riga ospita un numero variabile di elementi: 2 per la prima, 8 per la seconda e la terza, 18 per la quarta e la quinta, etc. I periodi sono numerati dall'alto verso il basso in modo tale che quello che incomincia con l'idrogeno (H) e' il primo e quello che incomincia con il francio (Fr) e' il settimo ed ultimo.
Il periodo di dice qual e' il livello elettronico esterno ancora occupato da elettroni per l'atomo in questione. Pertanto l'idrogeno e l'elio (He), che appartengono al primo periodo, presentano i loro elettroni piu' esterni (ed in effetti tutti i loro elettroni) nel primo guscio elettronico, con numero quantico principale n=1. Gli elementi dal litio (Li) al neon (Ne), che appartengono al secondo periodo, presentano i loro elettroni piu' esterni nel secondo guscio elettronico, con n=2, ed hanno ovviamente il primo guscio elettronico completo (1s2).
I GRUPPI. Gli elementi di ciascun periodo della tavola periodica sono ordinati in modo tale che ciascuno appartiene ad una colonna; non sono cioe' sfalsati in verticale. Le colonne della tavola periodica si definiscono gruppi ed indicano il numero di elettroni presenti nel lvello elettronico piu' esterno dell'atomo considerato.
Gli elementi appartenenti allo stesso gruppo hanno reattivita' simile e spesso possono scambiarsi nei composti: per questo alcuni gruppi hanno un nome, che si impiega quando si vuole indicare indifferentemente uno qualunque degli elementi del gruppo. Gli elementi del gruppo I, con l'esclusione dell'idrogeno, sono chiamati metalli alcalini; quelli del II gruppo metalli alcalino-terrosi; quelli del VII gruppo alogeni e quelli dell'VIII gruppo (che in alcune edizioni della tavola e' anche chiamato gruppo zero) gas nobili.
LA CHIMICA A 8 ELETTRONI. Gli elementi piu' importanti per la chimica degli organismi viventi, quelli che partecipano in maggior misura alla costruzione delle biomolecole sono H, C, N ed O. Con l'eccezione di H, questi elementi appartengono al secondo periodo e la loro costituzione elettronica esterna e' rispettivamente 2s2p2, 2s2p3 e 2s2p4. La costituzione elettronica esterna di massima stabilita' per gli elementi di questo periodo e' quella relativa al gas nobile neon (2s2p6) e implica la presenza di otto elettroni distribuiti in quattro coppie nell'unico orbitale 2s e nei tre orbitali 2p. Nei loro composti C, N ed O formano legami in modo tale da approssimare la struttura elettronica del neon; pertanto compiono una chimica che e' definita ad 8 elettroni o dell'ottetto.
METALLI E NON METALLI. Un elemento che tende facilmente a cedere i suoi elettroni per formare ioni positivi e' definito un metallo. Il carattere metallico e' massimo per gli elementi che si trovano a sinistra nella tavola (gruppi I e II) e minimo per quelli che si trovano a destra. Inoltre, all'interno di ciascun gruppo, il carattere metallico aumenta man mano che cresce il periodo perche' gli elettroni esterni sono piu' lontani dal nucleo e sono quindi meno saldamente legati. Cosi', ad esempio, il cesio ha carattere metallico piu' marcato del litio. In breve, il carattere metallico segue un gradiente nella tavola periodica, essendo massimo nell'angolo in basso a sinistra e minimo nell'angolo in altro a destra.
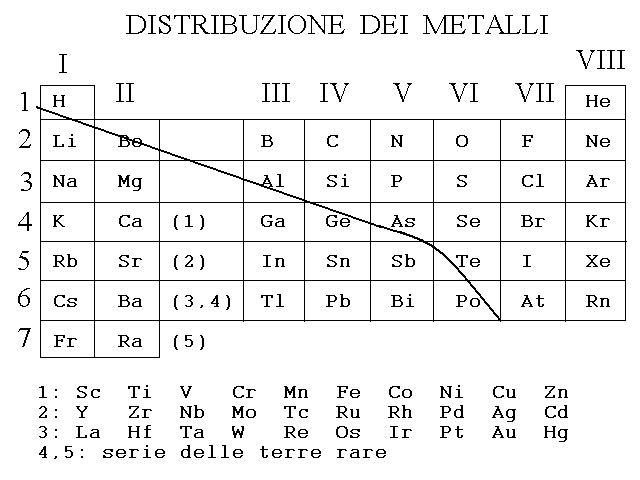
Fig. 15: distribuzione dei metalli e dei non-metalli nella Tavola Periodica.
USO DELLA TAVOLA PERIODICA: UN ESEMPIO. Si vuole determinare la struttura elettronica del calcio, a partire dalla posizione occupata da questo elemento nella tavola periodica. Lo stesso risultato sarebbe ottenibile attraverso l'aufbau, tenendo presente che il numero atomico del Ca e' 20; pero' il processo sarebbe alquanto lungo perche' si dovrebbero collocare uno ad uno 20 elettroni. La tavola periodica offre una soluzione piu' semplice.
La tavola periodica ci dice che il calcio appartiene al quarto periodo e al secondo gruppo (quello dei metalli alcalino-terrosi). Il periodo ci dice che nel Ca il livello elettronico piu' esterno ancora occupato da elettroni e' quello con n=4. Il gruppo ci dice che nel guscio elettronico esterno sono presenti 2 elettroni, i quali possono essere entrambi accolti nell'orbitale 4s; quindi la struttura elettronica esterna del Ca e' 4s2. Poiche' i livelli piu' interni devono essere completi, la struttura elettronica del calcio deve essere 1s2,2s22p6,3s23p6,4s2.
Torna a: didattica; pagina iniziale.