PRIMA FACOLTA' DI MEDICINA E CHIRURGIA - CLM "B"
SAPIENZA UNIVERSITA' DI ROMA
Le reazioni chimiche sono trasformazioni di molecole in altre molecole e richiedono la rottura e riformazione di legami chimici. Possono essere reversibili o irreversibili; soltanto per le prime si puo' definire una condizione di equilibrio chimico.
Nelle condizioni di temperatura e pressione prevalenti sulla terra, tutti gli atomi capaci di formare legami chimici (quindi con l'esclusione dei soli gas nobili) sono presenti all'interno di molecole o in forma di ioni. Le trasformazioni chimiche sono quindi trasformazioni di molecole in altre molecole (e non, ad esempio, scissioni di molecole in atomi isolati o combinazioni di atomi isolati in molecole).
Perche' una reazione chimica possa avvenire, una o piu' molecole di uno o piu' composti(detti reagenti) debbono urtarsi, alcuni dei legami chimici in esse presenti devono rompersi e gli atomi devono riarrangiarsi in nuove molecole (dette prodotti). Ad esempio:
Si vede in questo esempio che gli atomi dei reagenti (ossigeno in O2 e idrogeno in H2) e dei prodotti (idrogeno e ossigeno in H2O) sono sempre legati in molecole e che la reazione consiste in un riarrangiamento degli stessi atomi per formare nuove molecole.
EQUAZIONI CHIMICHE. Le reazioni chimiche sono descritte con un formalismo che si chiama equazione chimica. Ad esempio nella reazione di formazione dell'acqua descritta sopra si ha che idrogeno e ossigeno sono i reagenti (scritti a sinistra); l'acqua e' il prodotto (scritta a destra); i numeri che precedono le formule sono chiamati coefficienti stechiometrici ed indicano i rapporti in cui le sostanze si combinano (sia in termini di molecole che in termini di moli); la ferccia indica la direzione in cui la reazione procede e se e' doppia indica che la reazione puo' procedere in entrambe le direzioni (dai reagenti ai prodotti e dai prodotti ai reagenti):
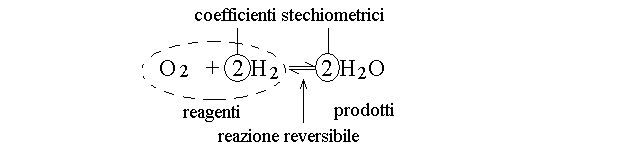
LEGGI DI CONSERVAZIONE. Nelle reazioni chimiche si ha rottura e formazione di legami chimici, con trasformazione di molecole in altre molecole; gli atomi non cambiano ne' in numero ne' in natura (gli atomi cambiano soltanto nelle reazioni nucleari, quali ad es. quelle della radioattivita' o quelle delle centrali nucleari). Pertanto si conservano (cioe' hanno lo stesso valore nei reagenti e nei prodotti):
1) la massa totale di sostanza
2) la carica elettrica
3) gli atomi
Nelle reazioni chimiche si conserva inoltre l'energia, che pero' richiede una trattazione separata. Per contro nelle reazioni nucleari non si conservano gli atomi e a voler essere precisi neppure la massa e l'energia perche' la prima viene in parte convertita nella seconda.
CONSERVAZIONE DEGLI ATOMI. Nella reazione:
si osserva che i reagenti contengono complessivamente 2 atomi di ossigeno (in una molecola di O2) e 4 atomi di idrogeno (in due molecole di H2); i prodotti contengono anch'essi 2 atomi di ossigeno e 4 di idrogeno (in 2 molecole di H2O): sebbene combinati tra loro in molecole diverse, gli atomi non sono cambiati nel corso della reazione.
CONSERVAZIONE DELLE CARICHE. Si puo' ancora osservare che nella stessa reazione i reagenti hanno carica netta totale uguale a zero e i prodottihanno anch'essi carica netta totale uguale a zero; non sono state quindi prodotte o consumate cariche elettriche (poiche' le cariche si trovano negli atomi, sotto forma di protoni ed eletrtroni, questa osservazione consegue alla precedente). Anche in reazioni nelle quali vengono generate cariche elettriche, non viene prodotta nessuna carica netta: ad esempio il colruro di sodio dissocia in ioni se disciolto in acqua, secondo la reazione: NaCl --> Na+ + Cl-; anche il questo caso il reagente ha carica netta uguale a zero e la somma delle cariche dei due prodotti (entrambi carichi) e' ancora uguale a zero.
CONSERVAZIONE DELLA MASSA. Anche la conservazione della massa consegue a quella degli atomi; occorre pero' fare una precisazione: l'equazione chimica puo' essere letta sia con riferimento alle molecole che con riferimento alle moli. Ad esempio, per il caso della formazione dell'acqua a partire da idrogeno e ossigeno, si puo' affermare che:
- La somma dei pesi molecolari di due molecole di idrogeno e una molecola di ossigeno risulta 2x2 + 1x32 = 36 U.M.A. La somma dei pesi molecolari di due molecole d'acqua risulta 2x18 = 36 U.M.A.
- La somma delle masse di due moli di idrogeno ed una mole di ossigeno risulta 2x2 + 1x32 = 36g. La somma dei pesi molecolari di due molecole d'acqua risulta 2x18 = 36g
In entrambi i casi la massa complessiva dei reagenti e' uguale alla massa complessiva dei prodotti: cioe' la massa si e' conservata.
BILANCIAMENTO. Si intende per bilanciamento di una reazione la ricerca (teorica e non sperimentale) dei coefficienti stechiometrici. In genere si procede elemento per elemento, controllando di volta in volta che masse e cariche siano conservate.
A titolo di esempio possiamo provare a bilanciare la reazione nella quale idrogeno e azoto reagiscono tra loro per formare ammoniaca:
E' evidente che il coefficiente stechiometrico di NH3 deve essere doppio di quello di N2 perche' ogni molecola di N2 contiene 2 atomi di azoto mentre ogni molecola di NH3 ne contiene soltanto 1. Dunque sono possibili le coppie n=1, m=2; n=2, m=4; etc. Si prende allora la prima coppia possibile (n=1, m=2) e si conta a quanti atomi di idrogeno corrisponde: la molecola di N2 non contiene idrogeno, quella di NH3 contiene 3 atomi di idrogeno. Poiche' si e' assunto m=2 si determina che 2 molecole di NH3 contengono 6 atomi di idrogeno, che corrispondono a 3 molecole di H2. Quindi i coefficienti stechiometrici sono n=1, h=3 e m=2. Se per l'idrogeno si fosse ottenuto un coefficiente non intero sarebbe stato necessario ripetere il ragionamento con la coppia successiva (n=2, m=4).
Per ragioni termodinamiche che saranno illustrate piu' avanti nessuna reazione chimica puo' essere realmente irreversibile; esistono pero' reazioni che sono praticamente irreversibili. Le reazioni praticamente irreversibili sono quelle che procedono fino ad esaurimento del reagente in difetto. Un esempio di reazione praticamente irreversibile e' dato dalla combustione del metano (il gas che usiamo comunemente per cucinare o per il riscaldamento domestico):
Se noi mettiamo in un recipiente una mole di metano ed una di ossigeno la reazione continua fino al completo esaurimento dell'ossigeno, e la miscela, alla fine dell'esperimento contiene 0,5 moli di metano, 0,5 moli di CO2, ed una mole di acqua. L'ossigeno scompare perche', essendo in difetto viene interamente consumato.
L'esempio chiarisce che il reagente in difetto deve essere identificato tenendo conto dei coefficienti stechiometrici della reazione. Infatti la completa ossidazione di una mole di metano richiederebbe due moli di ossigeno, mentre il consumo di una mole di ossigeno richiede mezza mole di metano. E' pertanto evidente che, pur essendo i due gas presenti nelle stesse quantita' iniziali (una mole di ciascuno) l'ossigeno e' in difetto e il metano e' in eccesso.
Nelle reazioni chimiche si conserva anche l'energia, ma questo non e' evidente dall'equazione chimica, che e' imprecisa su questo punto. L'energia puo' avere due forme: energia potenziale chimica, conservata nei legami chimici, ed energia attuale, sotto forma di calore o piu' raramente di radiazione elettromagnetica. Per mettere in evidenza la conservazione dell'energia dovremmo riscrivere l'equazione chimica aggiungendo un termine energetico; ad es.:
Dove Q indica il calore di reazione e ci informa che la trasformazione di idrogeno e ossigeno in acqua si accompagna al rilascio di energia e riscalda il recipiente nel quale avviene. Quando il calore di reazione appare tra i prodotti la reazione e' definita esotermica (o esoergonica) ed il bilancio dell'energia corrispondente e' il seguente:
La lettera H in questa equazione indica il "calore interno" delle molecole cioe' un parametro che rappresenta la somma delle energie di legame. Si deve ricordare che l'energia di legame e' formalmente negativa, in quanto corrisponde all'energia emessa nella formazione del legame (o, cio' che e' lo stesso, all'energia che e' necessario fornire alla molecola per rompere il legame). Di conseguenza, se Hreagenti > Hprodotti (come e' implicito nell'eq. 1) i legami complessivamente presenti nelle molecole dei reagenti sono meno stabili o meno forti di quelli complessivamente presenti nelle molecole dei prodotti.
Dall'eq. 1 si ricava:
Ovvero: nelle reazioni esotermiche si ha sempre Δ H < 0.
Quando il calore di reazione appare tra i reagenti, la reazione e' definita endotermica (o endoergonica) ed ha:
CALCOLO DELL'ENTALPIA. Continuiamo a considerare come esempio la reazione di formazione dell'acqua in fase gassosa. Quando due molecole di idrogeno reagiscono con una di ossigeno per formarne due di acqua, devono rompersi due legami H-H ed il doppio legame O=O (orbitali di tipo σ e π); si formano invece quattro legami O-H. Il bilancio dell'energia e' il seguente:
| H2 --> 2 H | assorbe 104 kcal / moleH2 | totale: -208 kcal |
| O2 --> 2 O | assorbe 120 kcal / moleO2 | totale: -120 kcal |
| H + O --> O-H | cede 111 kcal / moleOH | totale: +444 kcal |
| Q = +116 kcal |
Il calcolo dimostra che Δ H = -Q = -116 kcal/moleO2 = -58 kcal/moleH2O.
ENTALPIE MOLARI STANDARD. La formula (2) implica che sia possibile assegnare ad ogni composto un valore di H (il suo "calore interno"); e che se noi conoscessimo questo valore potremmo calcolare il Δ H di qualunque reazione. Potrebbe sembrare razionale calcolare il valore di H a partire dalle energie di legame, come e' stato fatto sopra; questo equivarrebbe ad utilizzare il livello energetico degli atomi isolati come livello di riferimento. Purtroppo questo livello di riferimento sarebbe difficile da utilizzare in pratica perche' sono richieste energie molto grandi per rompere le molecole in atomi. Pertanto per determinare il valore di H di ogni composto si fa riferimento al Δ H della sua formazione a partire dagli elementi costituenti nel loro stato elementare e a condizioni standard (1 M per i soluti, 1 atm per i gas e T = 298 K). Il valore di H cosi' determinato si chiama entalpia molare standard di formazione del composto. Secondo questa convenzione il valore di H di un elemento nel suo stato elementare e' uguale a zero (e quello dei suoi atomi e' positivo per alcune decine di kcal/mole). Ad es. l'entalpia molare standard di formazione dell'acqua in fase gassosa, come calcolata sopra e' -58 kcal/mole.
| Energie molari standard di formazione di alcuni composti gassosi | |||
| Hf0 | Sf0 | Gf0 | |
| H2 gas | 0 | 31,21 | 0 |
| O2 gas | 0 | 49,00 | 0 |
| H2Ogas | -57,80 | 45,11 | -54,64 |
| CO2 gas | -94,05 | 51,06 | -94,26 |
| CO gas | -26,42 | 47,30 | -32,81 |
| NO gas | 21,60 | 50,34 | -20,72 |
| NH3 gas | -11,04 | 46,01 | -3,98 |
| HCl gas | -22,06 | 44,62 | -22,77 |
| Valori in kcal/mole a condizioni normali (298 K e 1 atm); Sf0 in kcal/K.mole | |||
USO DELLE ENTALPIE MOLARI STANDARD: UN ESEMPIO. La reazione di combustione del glucosio e' fondamentale per il metabolismo dell'uomo; la sua equazione chimica complessiva e':
C6H12O6 + 6 O2 --> 6 CO2 + 6 H2O
Il Δ H di questa reazione puo' essere determinato sperimentalmente oppure calcolato dai dati tabulati come segue:
si scrive un immaginario intermedio di reazione che rappresenti gli stati elementari degli atomi coinvolti nella rezione:
C6H12O6 + 6 O2 --> 6 C solido + 6 H2 + 9 O2 --> 6 CO2 + 6 H2O
La prima reazione e' l'inverso della formazione del glucosio, e delle 9 molecole di ossigeno ve ne contribuiscono solo 3; dalle tabelle si ricava Δ H = Hf0 = 301 kcal/mole (questo valore e' riportato con segno cambiato perche' la reazione e' l'inversa della formazione, che ha Δ H = -301 kcal/mole).
La seconda reazione presenta Δ H = 6 Hf0H2O + 6 Hf0CO2 = 6x(-57,8) + 6x(-94,05) = -912 kcal/mole di glucosio. A questi dobbiamo aggiungere, se necessario rispetto alle condizioni del nostro esperimento, 6x(-9,7 kcal/mole) per tenere conto della liquefazione dell'acqua (nella tabella il calore molare standard e' dato per la formazione di acqua in fase di vapore), e otteniamo -972 kcal/mole di glucosio.
Il Δ H della reazione globale e' -972 + 301 = -671 kcal/mole. Se lo si desidare si puo' dividere questo valore per il peso molare del glucosio (180 g/mole) per ottenere l'equivalente Δ H = -3,73 kcal/g. Nelle condizioni interne all'organismo (che non sono standard) questa energia e' pari a -4,1 kcal/g e questo e' il cosiddetto potere nutritivo del glucosio.
ENTROPIE ED ENERGIE LIBERE MOLARI STANDARD. Oltre all'entalpia molare standard di formazione dei composti sono tabulate anche le entropie (S) ed energie libero (G) molari standard , con significati del tutto analoghi. Si ricordi pero' che l'enatlpia e' praticamente indipendente dalla temperatura mentre l'entropia dipende dalla temperatura ed e' misurata in kcal/K.mole; l'uso e' sempre in formule nelle quali si ha il prodotto T S (o T Δ S).
L'energia libera molare standard (Δ G) risulta dalla somma algebrica dei contributi entalpico (il Δ H, preso con il suo segno) ed entropico moltiplicato per la temperatura assoluta (T Δ S), preso con segno opposto:
Il Δ Gdella reazione misura la tendenza di questa ad avvenire; se e' negativo (Δ G < 0) indica che la reazione considerata e' spontanea a condizioni standard; se invece e' positivo (Δ G > 0) indica che a condizioni standard e' spontanea la reazione inversa (cioe' i prodotti tendono a trasformarsi nei reagenti). La ragione per la quale i contributi entalpico ed entropico sono presi con segno opposto e' la seguente: ogni sistema termodinamico tende alla condizione di minima energia potenziale (diminuzione di H, favorita se Δ H < 0) e di massimo disordine (aumento di S, favorita se Δ S > 0).
Che cosa accade durante la reazione chimica? Alcune molecole (i reagenti) si convertono in altre molecole (i prodotti). Questo passa attraverso la rottura di legami chimici e la formazione di nuovi legami chimici. Ad esempio:
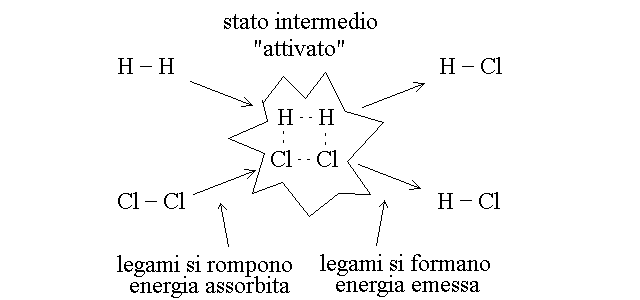
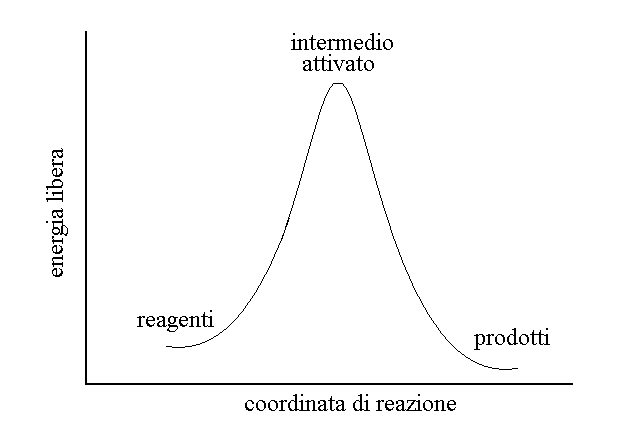
Rompere un legame chimico assorbe energia; formarlo ne emette. Ogni reazione chimica inizia con un processo energeticamente sfvorevole (un "debito" di energia) e termina con uno energeticamente favorevole. Infatti i reagenti, urtandosi tra loro, usano la loro energia cinetica per rompere o indebolire almeno alcuni dei legami chimici presenti nelle loro molecole formando l'intermedio attivato; i nuovi legami, caratteristici del prodotto si riformano tra gli atomi dell'intermedio attivato liberando energia di legame sotto forma in genere di calore. Lo stato intermedio attivato e' sempre uno stato instabile, ad alta energia. Definendo la coordinata di reazione, un qualunque parametro arbitrario capace di distinguere i reagenti dai prodotti (ad es. una distanza interatomica), si puo' costruire un grafico dell'energia libera in funzione del passaggio dai reazenti all'intermedio attivato e da questo ai prodotti; si osservera' allora che l'intermedio attivato e' sempre un massimo energetico:
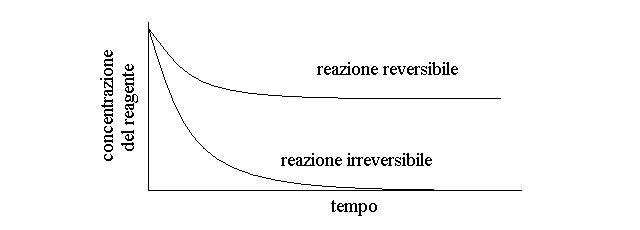
In teoria tutte le rezioni chimiche sono reversibili, ma alcune lo sono in misura cosi' piccola che la concentrazione del reagente presente ad equilibrio e' troppo bassa per essere rivelata dai nostri strumenti di misura; queste sono definite, impropriamente, reazioni irreversibili.
Una reazione irreversibile procede fino al totale consumo dei reagenti (o del reagente presente in minor quantita'), mentre una reazione reversibile procede fino ad una condizione definita di equilibrio:
Cio' che impedisce alla reazione reversibile di procedere fino all'esaurimento del reagente in difetto e' il fatto che i prodotti neoformati vanno incontro alla reazione inversa e riformano i reagenti. Di conseguenza lo stato di equilibrio e' una condizione dinamica nella quale il reagente viene costantemente consumato nella reazione diretta e riformato nella reazione inversa. Ad esempio nella reazione, gia' spiegata, di formazione dell'acqua:
due molecole d'acqua possono urtarsi e trasformarsi in idrogeno ed ossigeno, rigenerando quindi i reagenti consumati. Nella condizione di equilibrio la velocita' con la quale i reagenti vengono consumati nella reazione diretta eguaglia la velocita' con la quale questi vengono riformati nella reazione inversa; pertanto la concentrazione dei reagenti e dei prodotti rimane costante nel tempo.
Quando una reazione ha raggiunto la condizione di equilibrio vale la legge di azione delle masse, secondo la quale e' costante il rapporto tra il prodotto delle concentrazioni dei prodotti ed il prodotto delle concentrazioni dei reagenti, ciascuna elevata al proprio coefficiente stechiometrico. Ad esempio:
O2 + 2 H2 <==> 2 H2O ; K = [H2O]2 / ([O2] [H2]2)
REAZIONI INVERSE. Si puo' facilmente dimostrare che la costante di equilibrio della reazione inversa ad una reazione data e' pari al reciproco della costante di equilibrio di quest'ultima. Ad esempio siano la reazione data e la sua costante di equilibrio:
N2 + 3 H2 <==> 2 NH3 ; K = [NH3]2 / ([N2] [H2]3)
La reazione inversa e la sua costante di equilibrio saranno:
2 NH3 <==> N2 + 3 H2 ; K' = ([N2] [H2]3) / [NH3]2 = 1 / K
UNITA' DI MISURA DELLA COSTANTE DI EQUILIBRIO. La costante di equilibrio ha le dimensioni di una molarita' elevata ad un fattore di potenza positivo o negativo; soltanto se il fattore di potenza risulta uguale a zero, la costante e' un numero puro. Ad esempio:
K = [H2O]2M2 / ([O2]M [H2]2M2) si misura in M-1
K = [NH3]2M2 / ([N2]M [H2]3M3) si misura in M-2
SIGNIFICATO DELLA COSTANTE DI EQUILIBRIO. La costante di equilibrio e' caratteristica di ogni reazione (cioe' ogni reazione ha la sua, in linea di principio diversa da ogni altra) e dipende dalla temperatura (cioe' il suo valore cambia se cambiamo la temperatura dell'esperimento.
Ovviamente la costante di equilibrio non dipende dalle concentrazioni iniziali dei reagenti e dei prodotti. Ad esempio si supponga che la costante di equilibrio della reazione omogenea in fase gassosa: A + 2 B <==> C sia K = 1 M-2, che il sistema occupi un volume di 1 litro, e che si abbia la condizione [A] = [B] = [C] = 1 M, tale che:
[C] / ([A] [B]2) = 1 / (1 x 12) = 1 = K
Si raddoppi ora il volume a disposizione della miscela portandolo a 2 litri; ogni concentrazione sara' istantaneamente dimezzata e si otterra' la condizione di non-equilibrio:
[C] / ([A] [B]2) = 0,5 / (0,5 x 0,52) = 4 > K
Questo non vuol dire che la costante e' cambiata, ma che il sistema non e' ad equilibrio. Il rapporto tra il prodotto delle concentrazioni dei prodotti ed il prodotto delle concentrazioni dei reagenti, ciascuna elevata al suo coefficiente stechiometrico, risulta maggiore di K; questo vuol dire che siamo in presenza di un eccesso di prodotti e che la reazione dovra' andare verso sinistra (cioe' un po' di prodotto sara' consumato e un po' di reagenti saranno formati). Si puo' calcolare che l'equilibrio viene ristabilito quando 0,13 moli/litro di C si trasformano in 0,13 moli/litro di A + 0,13x2=0,26 moli/litro di B (le moli di reagenti e di prodotti si formano o si consumano in proporzione ai rispettivi coefficienti stechiometrici). I valori di concentrazione ad equilibrio cosi' calcolati ci portano a:
[A] = 0,5 + 0,13 = 0,63 M
[B] = 0,5 + 0,13x2 = 0,76 M
[C] = 0,5 - 0,13 = 0,37 M
[C] / ([A] [B]2) = 0,37 / (0,63 x 0,762) = 1 = K
L'esempio dimostra che in una reazione ad equilibrio non e' costante nessuna concentrazione e nessun rapporto tra concentrazioni: l'unica cosa che non varia e' la costante di equilibrio che mantiene lo stesso valore a dispetto di qualunque perturbazione apportata al sistema (purche' non venga variata la temperatura).
E' molto importante sottolineare che i reagenti si consumano ed i prodotti si formano (o viceversa) in quantita' che stanno tra loro come i rispettivi coefficienti stechiometrici. Questa e' una ovvia conseguenza della conservazione della massa vista in precedenza, ed e' facile dimostrare che l'esempio proposto soddisfa alla conservazione della massa. Infatti prima di perturbare l'equilibrio del sistema si aveva: V = 1 litro; nA = [A]xV = 1 mole; nB = [B]xV = 1 mole; nC = [C]xV = 1 mole. Supponiamo di poter convertire tutto C in A e B: si otterranno 1 mole di A e 2 moli di B che sommate a quelle gia' presenti ci danno in totale nA tot = 1+1 = 2 moli; nB tot = 1+2 = 3 moli. Nella nuova condizione di equilibrio abbiamo V = 2 litri; nA = [A]xV = 0,63x2 = 1,26 moli; nB = [B]xV = 0,76x2 = 1,52 moli; nC = [C]xV = 0,37x2 = 0,74 moli. Supponendo di nuovo di poter convertire tutto C in A e B, si otterrebbero 0,74 ulteriori moli di A e 1,48 di B che ci porterebbero ai seguenti totali: nA tot = 1,26+0,74 = 2 moli; nB tot = 1,52+1,48 = 3 moli.
Per avere una rappresentazione visiva della conservazione della massa e dell'importanza dei rapporti stechiometrici si immagini di rappresentare le molecole del nostro esempio con i giochi di costruzioni usati dai bambini, in questo modo:
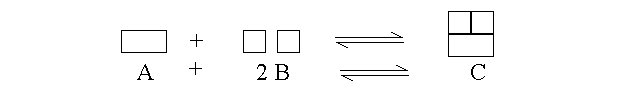
E' evidente in questa rappresentazione che ogni volta che una molecola di C si dissocia vengono prodotte una molecola di A e due di B, o viceversa che ogni volta che una molecola di C si forma vengono consumate una molecola di A e due di B. Non e' possibile formare una molecola di C a partire da qualcosa di diverso da una molecola di A e due di B. Se n molecole di C si dissociano, saranno quindi prodotte n molecole di A e 2n molecole di B, qualunque sia il valore di n.
Spesso non vengono determinate tutte le concentrazioni delle specie chimiche presenti ad equilibrio, ma solo alcune di esse, o al limite una sola, e quelle mancanti vengono calcolate a partire dall'equazione chimica. Si consideri il seguente esempio:
Vengono pesati 2g di ammoniaca e messi in un recipiente del volume di 10 litri. La temperature viene portata a 500 C e si stabilisce il seguente equilibrio in fase omogenea gassosa:
Ad equilibrio la concentrazione di ammoniaca risulta pari a 0,005 M. Calcolare la costante di equilibrio della reazione.
Soluzione: calcoliamo in primo luogo le moli di sostanza introdotte nel recipiente di reazione:
nNH3 = 2 g / 17 g/mole = 0,118 moli
nN2 = 0
nH2 = 0
sappiamo inoltre che ad equilibrio raggiunto il recipiente contiene:
nNH3 = C x V = 0,005 M x 10 L = 0,05 moli
Raccogliamo questi dati in una tabella:
| nNH3 | nN2 | nH2 | |
| moli iniziali | 0,118 | 0 | 0 |
| moli consumate o prodotte | |||
| moli ad equilibrio | 0,05 |
Ovviamente, il nostro obbiettivo e' riempire l'ultima riga della nostra tabella, tenendo presente che le colonne sono somme algebriche: ad esempio, per cio' che attiene alla prima collonna possimao chiederci quante moli di ammoniaca siano state consumate (cioe' sottratte) alle moli iniziali per portare la quantita' di questa sostanza da 0,118 a 0,05 moli. La risposta a questa domanda e' 0,118 - 0,05 = 0,068 moli.
Quante moli di azoto e idrogeno si producono quando vengono consumate 0,068 moli di ammoniaca? Occorre tener conto dei coefficienti stechiometrici:
N2 si produce in rapporto di 1:2 con la NH3 consumata; quindi 0,068/2 = 0,034 moli
H2 si produce in rapporto di 3:2 con la NH3 consumata; quindi 0,068x3/2 = 0,102 moli
Raccogliamo questi dati nella tabella di cui sopra, prendendo con segno positivo le moli prodotte e con segno negativo quelle consumate (li scrivo in corsivo per aumentare la chiarezza della tabella). Calcoliamo quindi per somma di ogni colonna le moli ad equilibrio (in grassetto):
| nNH3 | nN2 | nH2 | |
| moli iniziali | 0,118 | 0 | 0 |
| moli consumate o prodotte | -0,068 | 0,034 | 0,102 |
| moli ad equilibrio | 0,05 | 0,034 | 0,102 |
E' importante verificare che le moli consumate o prodotte, ignorando il segno, stiano tra loro come i coefficienti stechiometrici della reazione:
0,068 : 0,034 : 0,102 = 0,034x2 : 0,034 : 0,034x3 = 2 : 1 : 3
Si verifica inoltre che non sia stata violata la legge di conservazione degli atomi, come segue: i reagenti contenevano 0,118 grammoatomi di azoto e 0,118x3 = 0,354 grammoatomi di idrogeno. I prodotti contengono 0,05 grammoatomi di azoto nell'ammoniaca e 0,034x2 = 0,068 grammoatomi di azoto in N2 per un totale di 0,05+0,068 = 0,118 grammoatomi; contengono inoltre 0,05x3 = 0,15 grammoatomi di idrogeno nell'ammoniaca e 0,102x2 = 0,204 grammoatomi di idrogeno in H2. Gli atomi sono quindi stati conservati a dispetto della trasformazione chimica avvenuta.
Effettuate queste verifiche si passa a calcolare le concentrazioni ad equilibrio: [NH2] = 0,005 M (dai dati del problema); [N2] = 0,034 moli / 10 litri = 0,0034 M; [H2] = 0,102 moli / 10 litri = 0,0102 M. Questi valori permettono di calcolare la costante di equilibrio:
K = [N2] [H2]3 / [NH3]2 = 0,0034 x 0,01023 / 0,0052 = 1 / 6929 M2
Quando sia i reagenti che i prodotti sono gas perfetti, vale la relazione: Pi V = ni R T , nella quale i termini Pi e ni si riferiscono rispettivamente alla pressione parziale ed al numero di moli del componente i-esimo della miscela gassosa ad equilibrio. Da questa relazione si ricava:
Pi = ni R T / V = Ci R T
Questa equazione dimostra che la pressione parziale e' direttamente proporzionale alla concentrazione e suggerisce che si possa scrivere la costante di equilibrio per le pressioni parziali anziche' per le concentrazioni molari; in questa forma la costante di equilibrio prende il simbolo di Kp ed ha le unita' di misura di una pressione elevata ad un fattore di potenza positivo o negativo.
Ad esempio la reazione omogenea in fase gassosa:
N2 + 3 H2 <==> 2 NH3
ha: K = [NH3]2 / [N2] [H2]3 (in M-2)
e Kp = PNH32 / PN2 PH23 (in atm-2)
La relazione tra la Kp e la K (che in questi casi viene spesso indicata come Kc, costante espressa in concentrazioni) e' la seguente:
Kp = PNH32 / PN2 PH23 = [NH3]2 R2 T2/ [N2]RT [H2]3R3T3 = K / R2T2
In generale la relazione tra Kp e K (Kc) risulta: Kp = K (RT)Δ n dove Δ n rappresenta la differenza tra la somma dei coefficienti stechiometrici dei prodotti e la somma dei coefficienti stechiometrici dei reagenti (nel caso dell'esempio 2 e 3+1=4 con Δ n = -2).
Un equilibrio di dissociazione ha la generica equazione chimica: AB <==> A + B oppure A2 <==> 2 A . Consideriamo il primo caso; definiamo C la concentrazione analitica del reagente (come si potrebbe calcolare dalle formule n = peso/PM e C = n/V), assumiamo che i prodotti non fossero presenti all'inizio della reazione, e scriviamo:
[AB] = C (1 - α)
[A] = [B] = C α
Si ricordi che α , il grado di dissociazione e' definito come α = molecole dissociate / molecole totali e varia tra zero e uno). L costante di equilibrio risulta:
K = [A] [B] / [AB] = C2 α2 / C (1 - α) = α2 C / (1 - α)
Nel caso in cui i due prodotti di reazione siano uguali si ha:
reazione: A2 <==> 2 A
[A2] = C (1 - α)
[A] = 2 C α
K = [A]2 / [A2] = 4 C2 α2 / C (1 - α) = 4 α2 C / (1 - α)
A parita' di α e C la costante di dissociazione risulta 4 volte maggiore che nel caso precedente: ovvero e' necessaria una costante di dissociazione piu' grande per ottenere lo stesso valore di α . Questo si spiega perche', mentre la probabilita' della dissociazione del reagente e' in linea di principio la stessa nei due casi (non c'e' ragione per cui AB dovrebbe dissociare piu' in fretta di A2 o viceversa), l'incontro di due molecole di prodotto e' piu' probabile nel secondo caso (nel primo caso ogni A deve incontrare un B, mentre nel secondo caso ogni A deve incontrare un altro A, la cui concentrazione e' doppia di quella di B).
SIGNIFICATO E USO DELLA LEGGE DI OSTWALD. La legge di Ostwald consente di calcolare il grado di dissociazione degli elettroliti deboli o dei gas che dissociano parzialmente. Ad es. per la dissociazione del tipo AB <==> A + B , si ha K = α2 C / (1 - α) e:
α2 C + α K - K = 0
equazione di secondo grado completa in α , facilmente risolvibile. Inoltre se α << 1 si puo' approssimare (1 - α) a 1 e ottenere la formula semplificata:
α2 = K/C
La legge di Ostwald ci dimostra inoltre che il quadrato del grado di dissociazione e' inversamente proporzionale alla concentrazione (cioe': la diluizione aumenta la dissociazione), una applicazione del principio di Le Chatelier (vedi oltre).
Nei sistemi biologici l'equilibrio chimico governa alcuni processi importantissimi quali la combbinazione tra ormone e recettore, tra emoglobina e ossigeno, tra antigene e anticorpo, etc. Verra' proposto un esempio in questa sede, con l'avvertenza che le molecole coinvolte hanno formule chimiche molto complesse, che possono superare i 1000 atomi, e che pertanto non vengono rappresentate per intero. La reazione dell'esempio e' la combinazione tra la mioglobina (abbreviata come Mb) e l'ossigeno; la Mb e' una piccola proteina presente nel tessuto muscolare che svolge la funzione di conservare una riserva di ossigeno per il lavoro muscolare. Ogni molecola di Mb si combina reversibilmente con una molecola di O2 e la reazione viene in genere descritta come una dissociazione:
MbO2 <==> Mb + O2
la cui costante di equlibrio risulta:
K = [Mb] [O2] / [MbO2]
Una domanda importante dal punto di vista fisiologico e' la seguente: quale frazione di Mb e' ossigenata ad ogni dato valore della concentrazione di O2 ? Definiamo la concentrazione totale di mioglobina e Y, la frazione di MbO2:
[Mbtot] = [Mb] + [MbO2]
Y = [MbO2] / [Mbtot] = [MbO2] / ([Mb] + [MbO2])
Ovviamente Y deve essere compreso tra zero e uno (inclusi). Dalla costante di equilibrio otteniamo:
[O2] / K = [MbO2] / [Mb] = [MbO2] / ([Mbtot] - [MbO2])
[MbO2] K = [O2] [Mbtot] - [O2] [MbO2]
[MbO2] (K + [O2]) = [O2] [Mbtot]
Y = [O2] / (K + [O2])
L'equazione ottenuta descrive una iperbole equilatera che passa per l'origine degli assi ed ha asintoto orizzontale Y=1:
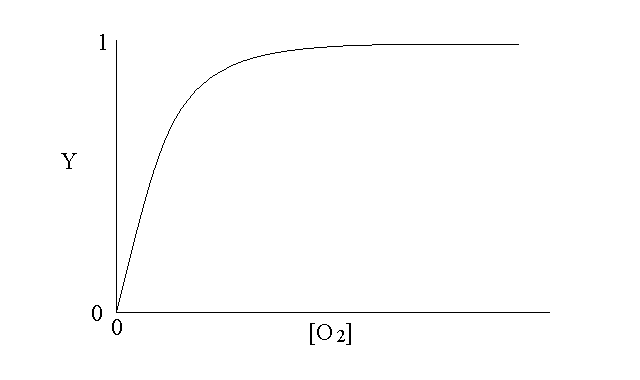
Aggiungiamo due osservazioni:
1) la costante di dissociazione ha le dimensioni di una molarita' ed e' omogenea con la concentrazione di O2; anzi si puo' osservare che l'equazione trovata si semplifica come segue per il punto di coordinate Y=0,5 e [O2]=[O2]50:
0,5 = [O2]50 / (K + [O2]50)
0,5 (K + [O2]50) = [O2]50
K + [O2]50 = 2 [O2]50
K = [O2]50
Ovvero: la costante di dissociazione e' pari alla concentrazione di O2 necessaria per ottenere Y = 0,5; questa concentrazione e' indicata come [O2]50 (o, genericamente, come C50). Il concetto della C50 e' usato ampiamente nella farmacologia e nella tossicologia: e' la dose di sostanza necessaria per ottenere la meta' dell'effetto massimo ottenibile.
2) per l'ossigeno disciolto in soluzione (ma non per quello legato alla Mb) vale la legge di Henry: [O2] = k PO2 . Consegue che la pressione e' direttamente proporzionale alla concentrazione del gas (o viceversa) e che pertanto l'equazione Y = [O2] / (K + [O2]) puo' essere riscritta nella forma:
Y = PO2 / (Kp + PO2)
Si noti che questa equazione presuppone un equilibrio eterogeneo tra O2 in fase gassosa e Mb in fase di soluto; pero' siccome Y e' un numero puro, questo non influenza le unita' di misura della Kc (M) o della Kp (atm). In analogia a quanto gia' detto sulla C50 vale anche Kp = P50 .
Perche' l'esempio della mioglobina e' importante? A parte il suo interesse per la fisiologia respiratoria, il concetto di C50 e' rilevante per molte applicazioni mediche. Infatti la natura iperbolica della curva di legame-dissociazione implica che non sia possibile stimare la concentrazione di ossigeno necessaria per ottenere la completa saturazione della mioglobina: la condizione Y=1 e' un asintoto esterno alla curva. Lo stesso vale per la dose di farmaco o di veleno che ottiene l'effetto "massimo" o "completo". Per contro e' molto facile definire le C50.
Gli esempi riportati finora (con la opossibile eccezione della Kp della mioglobina) riferiscono ad equilibri omogenei, cosi definiti perche' i reagenti ed i prodotti occupano la medesima fase termodinamica. Quando anche uno solo dei reagenti o dei prodotti si trova in una fase separata dagli altri si ha invece un equilibrio eterogeneo. Esempi di equilibri eterogenei sono quelli tra solidi e soluti in soluzione, quale quello di dissoluzione in acqua del cloruro di argento:
AgClsolido <==> Ag+aq + Cl-aq
dove il suffisso "aq" iondica lo ione solvatato in soluzione. Altri esempi di equilibrio eterogeneo sono quelli tra gas e soluti o tra gas e liquido. La costante di un equilibrio come quello del cloruro di argento presente una peculiarita': infatti se noi applichiamo la legge di azione delle masse otteniamo:
K = [Ag+] [Cl-] / [AgCl]
Osserviamo che in questa equazione il termine [AgCl] e' a sua volta costante: infatti il solido non si disperde nel volume di liquido disponibile ma rimane nel corpo di fondo ed il suo volume dipende soltanto dalla sua densita' (in formule: d = peso/V; n = peso/PM= dV/PM; concentrazione= n/V = d/PM). Di conseguenza e' possibile trasferire la concentrazione del solido nella costante di equilibrio ed ottenere:
Kps = K [AgCl] = [Ag+] [Cl-]
Il termine Kps si chiama prodotto di solubilita' ed ha le stesse proprieta' della costante di equilibrio da cui deriva (notiamo che quando facciamo una operazione di questo genere aggiungiamo alla costante un suffisso per ricordarci che rappresenta il prodotto tra la vera costante di equilibrio ed una o piu' concentrazioni invarianti). Il cloruro di argento e' un sale poco solubile del il suo Kps ha il valore di 10-10 M2. Dal Kps e' possibile ricavare la concentrazione della soluzione satura (chiamata anche solubilita' del sale):
Csat = [Ag+] = [Cl-] = √ Kps = 10-5 M
Il prodotto di solubilita' ha interesse in medicina per due motivi:
1) la matrice minerale dell'osso e' un precipitato di fosfato di calcio
2) i calcoli urinari o biliari sono spesso precipitati di sali di calcio poco solubili.
EFFETTO DELLO IONE COMUNE. Se si tenta di sciogliere un sale poco solubile in una soluzione che contenga gia' un altro sale (o un altro soluto) con uno ione comune con il primo, la solubilita' del primo e' fortemente ridotta. Ad esempio si immagini di disciogliere AgCl in una soluzione 0,1 M di NaCl (o di HCl); le concentrazioni degli ioni presenti in soluzione saranno:
[Na+] = 0,1 M
[Cl-] = 0,1 M
[Ag+] = Kps / [Cl-] = 10-10 / 0,1 M = 10-9 M
Questo fenomeno si chiama effetto dello ione comune ed e' usato in laboratorio per precipitare i sali poco solubili, ad es. per la determinazione gravimetrica (cioe' mediante il peso del sale precipitato) o per recuperare metalli pregiati (ad es. l'argento dai bagni di sviluppo fotografici).
Il principio di Le Chatelier stabilisce che un sistema inizialmente in equilibrio, al quale sia stata applicata una perturbazione, trova una nuova cndizione di equilibrio nella direzione che minimizza l'effetto della perturbazione. Questo principio pertanto non si limita ad affermare che ogni sistema chimico trova una condizione di equilibrio, ma ci informa sulla direzione in cui l'equilibrio sara' trovato. Ad esempio, se noi diluiamo una soluzione di un elettrolita debole capace di dissociazione reversibile secondo una legge chimica del tipo AB <==> A + B , il principio di Le Chatelier ci informa che il nuovo equilibrio sara' trovato in un aumento del grado di dissociazione (come del resto si deduce dalla legge di Ostwald), perche' in questo modo aumenta il numero di particelle, che occupano il maggior volume di solvente reso disponibile (ovvero il sistema reagisce alla perturbazione -diminuzione della concentrazione- in modo da minimizzarla -aumento delle particelle di soluto-).
EFFETTO DELLA CONCENTRAZIONE DEI REAGENTI E DEI PRODOTTI. Sia il principio di Le Chatelier che la legge di azione delle masse ci dimostrano che se ad una reazione chimica in equilibrio vengono aggiunti i suoi prodotti, il sistema trova una nuova condizione di equilibrio spingendo la reazione verso sinistra (cioe' verso la formazione dei reagenti), mentre se vengono aggiunti ulteriori reagenti la nova condizione di equilibrio sara' trovata spingendo la reazione verso destra (cioe' verso la formazione dei prodotti). Abbiamo gia' visto un esempio di questo fenomeno nella precipiotazione dei sali poco solubili causata dall'aggiunta dello ione comune.
EFFETTO DELLA TEMPERATURA SULLA COSTANTE DI EQUILIBRIO Se una reazione chimica e' esotermica (cioe' emette calore quando avviene; il calore di reazione compare tra i prodotti anziche' tra i reagenti) la sua costante di equilibrio diminuisce quando noi aumentiamo la temperatura (poiche' il calore e' un prodotto, aumentare la temperatura equivale a far avvenire la reazione in presenza di un eccesso di prodotto e questo spinge la condizione di equilibrio verso sinistra, cioe' nella direzione della formazione dei reagenti). Se invece la reazione e' endotermica (cioe' avviene con assorbimento di temperatura, il calore di reazione compare tra i reagenti) la sua costante di equilibrio aumenta quando si innalza la temperatura. Queste relazioni sono espresse in forma di funzione algebrica nella legge di Van t'Hoff:
Spiegazione qualitativa della legge di Van t'Hoff: se si considera (ad esempio) una reazione endotermica, nella quale il calore di reazione compare tra i reagenti: Q + A + B <==> C + D si trova quanto segue. 1) In questa reazione Hreagenti < Hprodotti e Δ H0 = Hprodotti - Hreagenti > 0. 2) Per il principio di Le Chatelier un aumento della temperatura comporta uno spostamento della condizione di equilibrio verso destra, con consumo di reagenti e aumento dei prodotti. Questo accade perche' aumentare la temperatura equivale a fornire un "reagente" (il calore di reazione Q) e implica un aumento della costante di equilibrio. 3) Nella legge di Van t'Hoff se T1 > T0 e K1 > K0 si ottiene Δ H0 > 0.
RELAZIONE TRA IL Δ G0 E LA COSTANTE DI EQUILIBRIO. Il Δ G0 e la costante di equilibrio esprimono in modo quantitativo la tendenza di una reazione ad avvenire (cioe' entrambi misurano la tendenza dei reagenti a trasformarsi in prodotti); la relazione quantitativa tra questio due parametri e':
In questa relazione R, la costante universale dei gas e' espressa in cal/mole K ed ha il valore di 1,98 (si deve ricordare che le unita' di misura piu' comunemente usate per R, litri x atm / moli x K corrispondonoad un lavoro per mole e per grado K, e che un lavoro puo' essere espresso anche in cal o J; infatti il prodotto PxV corrisponde a forza/lunghezza2 x lunghezza3 = forza x lunghezza = lavoro).
Il termine Δ G0 rappresenta la variazione di energia libera per la conversione dei reagenti in una mole di prodotto, a condizioni standard (T=298 K, 1 atm per i gas, 1 M per i soluti). Una reazione e' spontanea a condizioni standard se ha Δ G0 < 0 ; se invece ha Δ G0 > 0 e' spontanea la reazione inversa (cioe' i prodotti tendono a trasformarsi in reagenti).
RAPPRESENTAZIONE GRAFICA DEL Δ G0. La rappresentazione grafica del Δ G0 richiede la definizione di un parametro, detto coordinata di reazione, che valga a distinguere i reagenti dai prodotti (ad es. una distanza interatomica):
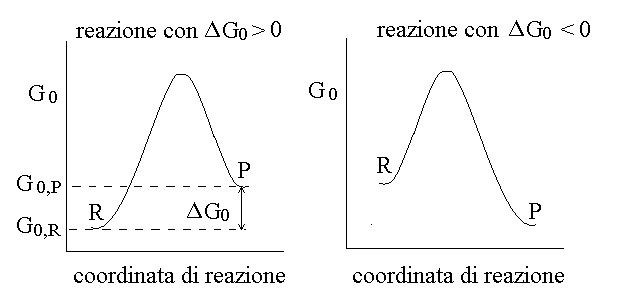
LA RELAZIONE Δ G0 = -RT ln K IMPLICA L'INESISTENZA DI REAZIONI CHIMICHE IRREVERSIBILI. Infatti se esistessero reazioni effettivamente irreversibili, capci di procedere fino al completo consumo del reagente in difetto, si avrebbe che la loro legge di azione delle masse si presenterebbe come una frazione con denominatore uguale a zero e quindi di valore tendente ad infinito. Pero' la relazione Δ G0 = -RT ln K applicata ad un valore di K tendente ad infinito ci darebbe una valore tendente ad infinito anche per il Δ G0 e questo violerebbe il primo principio della termodinamica. Consegue che quelle che comunemente chiamiamo reazioni irreversibili sono in realta' reazioni reversibili la cui condizione di equilibrio e' tanto spostata in favore dei prodotti che la concentrazione dei reagenti risulta non misurabile (ma non per questo zero).
Torna a: didattica; Medicine non Scientifiche; Biblioteca Digitale.