PRIMA FACOLTA' DI MEDICINA E CHIRURGIA - CLM "B"
SAPIENZA UNIVERSITA' DI ROMA
Le sostanze chimiche, nelle condizioni di temperatura e pressione ordinarie, possono trovarsi in tre stati di aggregazione: liquido, solido e gassoso. A temperature molto elevate (ad es. sulle stelle) le molecole si rompono e si puo' ottenere un quarto stato di aggregazione quello del plasma, un gas costituito da ioni ed elettroni; ovviamente lo stato di plasma non ha interesse per la medicina.
Nello stato gassoso le molecole della sostanza sono separate tra loro e si comportano in modo indipendente le une dalle altre; negli stati condensati (liquido e solido) le molecole stabiliscono tra loro interazioni chimiche particolari, dette deboli, e qualitativamente diverse dal legame chimico. Gli stati di aggregazione possono interconvertirsi tra loro, in genere in risposta a variazioni della temperatura e della pressione del sistema.
Molte sostanze sono gassose a temperatura ambiente: ad esempio l'azoto e l'ossigeno, i principali componenti dell'aria. Costituiscono un gas ideale (o perfetto) quelle molecole che a temperatura ambiente non formano interazioni tra loro e si comportano in modo completamente indipendente le une dalle altre. Le molecole di un gas perfetto si muovono nello spazio disponibile a velocita' costante e i loro urti con le pareti del recipiente che le contiene o con altre molecole sono elastici (cioe' conservano energia cinetica e quantita' di moto).
Non tutti i gas rispettano queste regole: le molecole di alcuni di essi (spesso definiti vapori o gas reali) possono formare transitorie interazioni deboli e possono dare urti anelastici, con formazione di temporanee interazioni intermolecolari. Ovviamente le interazioni intermolecolari nei gas reali sono molto deboli rispetto all'energia cinetica ed insufficienti a stabilizzare gli aggregati che rimangono sempre transitori e limitati a poche molecole (se non fosse cosi' il gas si trasformerebbe in uno stato condensato).
E' caratteristico dei gas il non avere forma e volume propri ma adattarsi e riempire il recipiente che li contiene, ed esercitare dsulle sue pareti una pressione, espressione macroscopica degli urti tra le molecole del gas in perenne movimento e le pareti del recipiente. Se si esercita una pressione dall'esterno il gas puo' essere compresso, cioe' costretto in un minor volume, ma quando la pressione viene diminuita il gas si riespande.
Per i soli gas ideali vale la seguente relazione, chiamata legge di stato dei gas perfetti:
E' possibile esprimere la costante R anche in altre unita' di misura (e ovviamente avra' un altro valore), ad esempio misurando la pressione in mmHg anziche' in atmosfere; l'unica unita' di misura che non puo' essere cambiata e' quella della temperatura che deve rimanere in Kelvin. Un sistema di unita' di particolare importanza per la chimica e' quello che esprime il prodotto P x V come una energia: infatti P ha le unita' di una forza divisa per una superficie e di conseguenza il prodotto P x V ha le dimensioni di una forza per una lunghezza. Se si usa come unita' di misura dell'energia la caloria, si ottiene R = 1,96 cal / (moli x Kelvin).
La legge o equazione di stato deriva da tre leggi separate, scoperte da Boyle (nel tardo 1600), Charles e Gay Lussac (nel 1800):
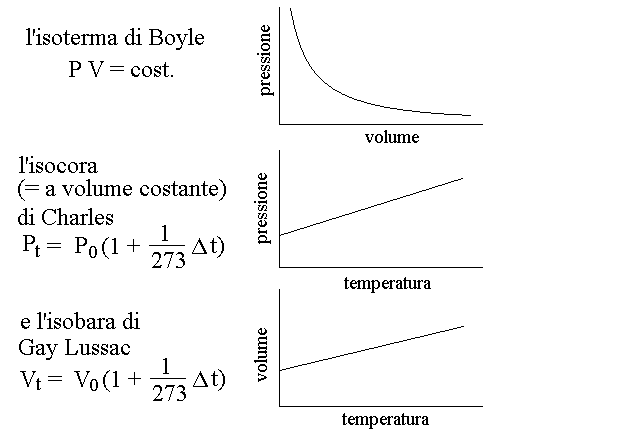
Figura 1: rappresentazioni grafiche delle leggi di Boyle, Charles e Gay Lussac.
La mole o grammomolecola e' una unita' di misura della quantita' di materia, applicabile alle sostanze pure di composizione ben definita. La definizione di mole e' la seguente:
Il numero di Avogadro e' pari a 6,02 x 1023 molecole/mole e di fatto parlare di mole e' come parlare di dozzine o di migliaia. La particolarita' del numero di Avogadro (N.A.) sta nel realizzare l'equivalenza tra l'unita' di massa atomica (U.M.A.) e il grammo: il grammo e' 6,02 x 1023 volte piu' grande dell'U.M.A.; oppure, cio' che e' lo stesso:
USO DELLA MOLE. Il concetto di mole e' molto importante nella chimica perche' consente di esprimere la quantita' di materia in unita' proporzionali al numero di molecole. Poiche' le sostanze reagiscono e si combinano tra loro secondo rapporti atomici e molecolari ben definiti, e poiche' la mole e' proporzionale al numero di molecole, i rapporti stechiometrici che intercorrono tra le moli sono gli stessi che intercorrono tra le molecole. Ad esempio nella reazione chimica:
O2 + 2 H2 <==> 2 H2O
si ha la combinazione di ossigeno e idrogeno nel rapporto di 1:2 tra le molecole; ma poiche' le moli sono direttamente proporzionali alle molecole (numero di moli = numero di molecole / N.A.), lo stesso rapporto vale anche per le moli. Pertanto se a livello microscopico si osserva che due molecole di idrogeno si combinano con una di ossigeno per formare due molecole di acqua, a livello macroscopico si avra' che due moli di idrogeno si combinano con una di ossigeno per formare due moli di acqua. Per contro l'uguaglianza tra i parametri del mondo macroscopico e quelli del mondo microscopico sarebbe perduta se noi misurassimo le quantita' di materia in grammi: infatti noti i pesi molecolari (2 per H2 e 32 per O2) si puo' calcolare che il rapporto pronderale per la combinazione dei due gas non e' 1:2 ma 4:32 = 1:8.
CALCOLO DEL NUMERO DI MOLI E DETERMINAZIONE DEI PESI MOLECOLARI. Per calcolare il numero di moli di una detreminata sostanza contenuto in una quantita' in peso nota si applica la formula:
Questa formula deriva direttamente dalla definizione di mole, con una avvertenza: P.M. puo' essere usato per indicare sia il peso molecolare (in U.M.A.) che il peso molare (peso di 1 mole di sostanza, in g / mole): infatti i due hanno lo stesso valore numerico e differiscono solo per le unita' di misura.
Se un esperimento ha consentito di determinare il numero di moli di una sostanza che sono contenute in una certa quantita' (nota) in peso, la formula precedente puo' essere riarrangiata per determinare il P.M.:
GRAMMOIONE, GRAMMOATOMO, GRAMMOFORMULA. In analogia con il concetto di mole si definiscono i concetti di:
Grammoatomo: un numero di Avogadro di atomi; pesa tanti grammi quante U.M.A. il peso atomico. Ad es. un grammoatomo di idrogeno pesa 1 g e contiene un numero di Avogadro di atomi di H (o 0,5 moli di H2).
Grammoione: un numero di Avogadro di ioni. Ad es. 23 g di ione Na+ costituiscono un grammoione sodio.
Grammoformula: un numero di Avogadro di unita' chimiche di un qualunque complesso di formula nota e definita. Ad es. una grammoformula di cloruro di calcio bi-idrato (una forma cristallina del cloruro di calcio che contiene due molecole di acqua di cristallizzazione per ogni unita' chimica del sale ed ha la formula CaCl2 . 2 H2O) pesa 40 + 2x35,5 + 2x18 = 146 g.
Il fisico L. Boltzmann dimostro' che l'energia cinetica (e quindi la velocita') delle molecole di un gas perfetto dipende dalla temperatura. L'equazione di Boltzmann descrive in modo quantitativo la relazione tra temperatura ed energia cinetica delle molecole (per il gas perfetto):
In questa equazione il termine NE / Ntot rappresenta la frazione di molecole che ha energia cinetica uguale o superiore ad un qualunque valore E (in calorie), e e' la base dei logaritmi naturali, R la costante dei gas in cal / (moli x Kelvin) e T la temperatura assoluta (in Kelvin). la velocita' delle molecole del gas perfetto si distribuisce come una gaussiana asimmetrica (cioe' ci sono poche molecole molto lente e poche molecole molto veloci e molte molecole con velocita' intermedie tra i due estremi), e a temperature diverse corrispondono distribuzioni piu' o meno ampie:
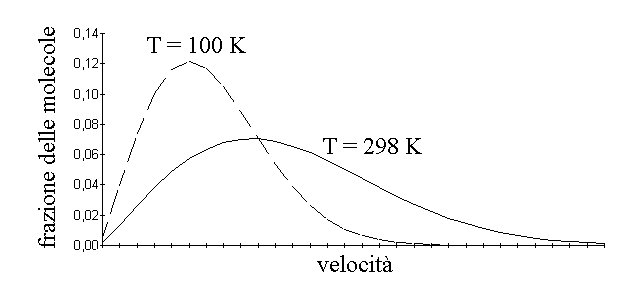
Figura 2: Distribuzione delle velocita' delle molecole di un gas perfetto a due temperature, come calcolate dall'eq. 3 (tenendo presente che la relazione tra energia cinetica e velocita' e' E = 1/2 m v2).
TEMPERATURA ASSOLUTA. L'equazione di Boltzmann stabilisce una equivalenza tra temperatura e energia cinetica delle molecole ed e' facile osservare che ad un aumento della temperatura corrisponde un aumento dell'energia cinetica (e della velocita') media delle molecole (si veda la fig. 2). Si puo' quindi affermare che la temperatura e' una misura indiretta dell'energia contenuta in una certa porzione di materia, energia che a livello macroscopico ha la forma del calore, e a livello microscopico di movimento traslazionale, rotazionale e vibrazionale delle singole molecole.
Se noi raffreddiamo una certa porzione di materia (cioe' le sottraiamo calore), cio' che effettivamente facciamo e' rallentare i movimenti delle molecole in essa contenute. Esiste una temperatura alla quale l'energia cinetica delle molecole e' nulla (cioe' le molecole sono ferme) e ovviamente non e' possibile andare al di sotto di questa temperatura che e' chiamata lo zero assoluto. In realta' non e' neppure possibile raggiungere lo zero assoluto ma soltanto approssimarlo.
Il volore dello zero assoluto rispetto alle scale termometriche piu' comuni puo' essere calcolato in vario modo; storicamente la prima stima dello zero assoluto venne dalle leggi di Charles e Gay Lussac attraverso le quali si dimostra empiricamente che il coefficiente di espansione termica del gas perfetto, rispetto alla temperatura di riferimento di 0 gradi centigradi e' 1/273 (fig. 1). Da questo consegue che alla temperatura di -273 gradi centigradi (in realta' -273,16) il volume o la pressione del gas dovrebbero essere uguali a zero e al di sotto di questa temperatura dovrebbero diventare negativi (cosa impossibile).
A partire da questa osservazione lord Kelvin propose una scala di temperatura i cui gradi hanno la stessa ampiezza dei gradi centigradi ed il cui zero corrisponde a -273,16 gradi centigradi. Su questa scala non vi sono temperature negative (valori minori di zero) e la scala prende il nome di scala assoluta di Kelvin. Vale la relazione:
Ad esempio alla temperatura di 25 gradi centigradi corrispondono 273,16 + 25 = 298,16 Kelvin (per gli usi pratici basta l'approssimazione a 298 K), a quella di -170 gradi centigradi (azoto liquido) corrispondono 273-170=103 K, e la temperatura centigrada di -300 semplicemente non esiste (nell'universo e nella scala Kelvin).
Il chuimico olandese Van Der Waals sviluppo' una equazione di stato che descrive il comportamento dei gas reali, mediante opportune correzioni apportate all'equaizone di stato dei gas ideali. A L'equazione di Van Der Waals applicata ad una mole di gas (quindi con n=1) e':
Questa equazione contiene due termini correttivi, il fattore a, che tiene conto della tendenza delle molecole ad aggregare tra loro e quindi ad esercitare una pressione diversa da quella attesa (gli urti sulle pareti del recipiente, che si traducono nella grandezza macroscopica chiamata pressione possono occasionalmente essere dovuti a particelle plurimolecolari dotate di massa maggiore dell'atteso), ed il fattore b, detto covolume, che tiene conto del volume fisicamente occupato dalle molecole del gas (il volume occupato dalle altre molecole risulta effettivamente inaccessibile ad ogni molecola e deve quindi essere sottratto dal volume totale a disposizione del gas).
Le interazioni (o legami) deboli si instaurano tra molecole (anziche' tra atomi, come avviene per il legame chimico forte) e non dipendono dalla formazione di orbitali di legame ma da fenomeni di attrazione elettrostatica. La piu' importante tra le interazioni deboli e' l'interazione dipolo-dipolo:
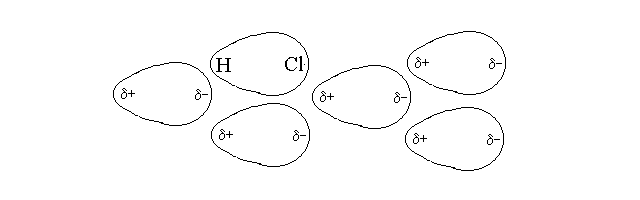
Figura 3: Legame dipolo-dipolo nell'acido cloridrico
Quando un sistema termodinamico e' costituito da molecole che sono dipoli stabili (cioe' molecole che presentano legami covalenti eteropolari e una separazione parziale di carica con distribuzione asimmetrica, tale da realizzare nella molecola una estremita' positiva e una estremita' negativa), questi hanno tendenza a disporsi in modo ordinato, tale da favorire l'interazione elettrostatica tra l'estremita' positiva di una molecola e quella negativa della molecola adiacente, come rappresentato nella fig. 3. E' importante notare che non tutte le molecole che contengono legami covalenti polari sono dipoli, perche' la separazione parziale di carica potrebbe non realizzare una distribuzione asimmetrica. Ad esempio nella molecola di anidride carbonica (CO2, O=C=O)i due doppi legami C=O sono polari ma la molecola e' lineare si presenta simmetrica con due poli negativi alle estremita' (in corrispondenza degli atomi di ossigeno) e un solo polo positivo al centro (in corrispondenza del carbonio).
IL LEGAME IDROGENO. Il legame idrogeno e' un caso particolare di interazione dipolo-dipolo, che si instaura quando il polo positivo del dipolo e' un atomo di idrogeno (legato ad un atomo fortemente elettronegativo). Poiche' l'idrogeno possiede un solo elettrone, quando si impegna in una molecola polare rimane nella forma di un nucleo nudo, con densita' di carica positiva molto alta. Pertanto il legame idrogeno ha una energia relativamente elevata (3-5 kcal/mole, da confrontare con le 50-100 kcal/mole tipiche del legame chimico forte, e con 1-2 kcal/mole tipiche delle altre interazioni deboli). Un esempio di legame idrogeno si osserva nell'acqua:
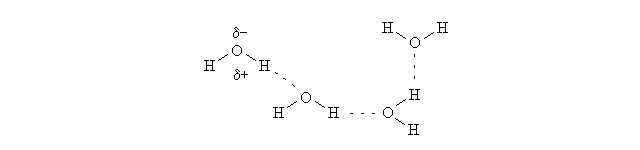
Figura 4: Legami idrogeno tra le molecole dell'acqua.
LEGAME DIPOLO-DIPOLO INDOTTO. In alcuni casi molecole che non possiedono un momento dipolare (ad es. perche' formate mediante legami covalenti poco polari, con scarsa differenza di elettronegativita' tra gli atomi costituenti) possono essere costrette ad assumere una (debole) polarita' dalla vicinanza con molecole fortemente polari quali l'acqua. Si ha in questo caso una interazione dipolo-dipolo indotto, a bassissima energia.
LEGAME IONE-DIPOLO. Quando un soluto ionico (ad es. un sale) viene disciolto in acqua esso si dissocia negli ioni positivi e negativi che lo costituiscono. Entrambi i tipi di ioni interagiscono con le molecole polari dell'acqua circondandosene; quelli positivi orientano le molecole dell'acqua in modo che esse presentino allo ione positivo la loro estremita' negativa (l'ossigeno); gli ioni negativi invece orientano le molecole d'acqua in modo che esse gli presentino la loro estremita' positiva (gli idrogeni):
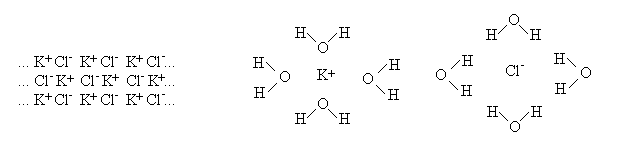
Figura 5: Legami ione-dipolo tra il cloruro di potassio e l'acqua.
Le molecole d'acqua ordinate intorno a uno ione (o a qualunque altra molecola immersa nel liquido) costituiscono la sua sfera di idratazione (vedi oltre, soluzioni).
FORZE DI VAN DER WAALS. Anche molecole che non sono dipoli presentano sulla loro superficie esterna orbitali abitati da elettroni in costante movimento con occasionali e temporanei addensamenti e rarefazioni dell'intensita' della carica superficiale. Inoltre il movimento degli elettroni genera sulla superficie di tutte le molecole deboli campi magnetici. Le forze elettromagnetiche caratteristiche delle superfici molecolari causano deboli fenomeni di attrazione tra le molecole, chiamati forze di Van Der Waals. Le forze di Van Der Waals sono evidenti soprattutto nelle molecole non polari, che sono incapaci delle piu' energiche interazioni dipolo-dipolo. Anche se le forze di Van Der Waals sono molto deboli, per il fatto di essere distribuite sull'intera superficie delle molecole interagenti, esse possono portare ad interazioni di una certa intensita' se le molecole sono grandi ed hanno superfici complementari, che possono realizzare un buon contatto. Se le molecole si avvicinano oltre un certo limite, pero' le forze di Van Der Waals diventano repulsive; il risultato e' che molecole con superfici non complementari hanno interazioni di Van Der Waals complessive molto deboli perche' l'avvicinamento dei punti piu' sporgenti puo' avere un effetto repulsivo.
Negli stati di aggregazione condensati (liquido e solido) le energie di interazione delle molecole della sostanza considerata sono piu' grandi delle energie cinetiche e quindi le molecole tendono a rimanere aggregate piuttosto che separarsi come avviene invece nei gas. A differenza dei gas, gli stati condensati non hanno una equazione di stato e non c'e' una correlazione universale tra i parametri macroscopici (P, V e T) e il numero di moli o di molecole del campione.
Se l'energia cinetica delle molecole e' dello stesso ordine di grandezza dell'energia delle interazioni deboli che queste possono formare tra loro, le interazioni deboli si formano e si rompono continuamente e si ha lo stato liquido.
Se invece l'energia cinetica delle molecole e' significativamente inferiore a quella delle interazioni deboli che queste possono formare tra loro, si ha lo stato solido.
L'energia dei legami che le molecole possono formare tra loro dipende dal tipo di molecole considerato ma e' sostanzialmente indipendente dalla temperatura; ad esempio le molecole d'acqua formano tra loro legami idrogeno con energia di circa 4-5 kcal/mole a tutte le temperature. Per contro l'energia cinetica delle molecole dipende dalla temperatura. Come conseguenza tutte le sostanze possono trovarsi in tutti gli stati di aggregazione, a diverse temperature. Ad esempio sotto gli zero gradi centigradi l'acqua e' solida (ghiaccio, neve) perche' l'energia cinetica delle molecole e' piu' piccola di quella dei legami idrogeno; tra gli zero e i cento gradi l'acqua e' liquida, perche' le energie cinetiche e di interazione sono tra loro simili; e a temperature superiori a cento gradi l'acqua e' gassosa perche' l'energia cinetica delle molecole e' molto superiore a quella dei legami idrogeno. Come vedremo piu' avanti, oltre alla temperatura c'e' un altro parametro che ha fondamentale importanza ai fini di determinare lo stato di aggregazione di ogni sostanza, la pressione.
CONSIDERAZIONI ENERGETICHE; ENTROPIA ED ENTALPIA. Quali forze stabilizzano gli stati di aggregazione della materia? Nel caso dei gas le molecole non contraggono interazioni deboli tra loro (gas ideali) o lo fanno in modo modesto (gas reali); esse si distribuiscono quindi in modo disordinato ad occupare tutto il volume disponibile e molte disposizioni diverse (una molecola qua e una la o viceversa) portano allo stesso stato finale. Il gas e' quindi uno stato altamente probabile del sistema ed e' stabilizzato dalla sua grande entropia.
Nel caso dei liquidi e dei solidi, le molecole non si limitano ad occupare lo stesso volume ma interagiscono fortemente tra loro ed assumono disposizioni spaziali piu' o meno definite; questo rende questi stati meno probabili e quindi da un minor contributo entropico. In cambio le energie delle interazioni deboli intermolecolari danno un contributo di tipo entalpico.
Possiamo chiarire meglio questi termini nel modo seguente: uno stato termodinamico di un qualunque sistema e' stabilizzato o favorito da due tipi di contributi energetici. Il primo e' probabilistico: lo stato in questione potrebbe essere il piu' probabile (contributo entropico). Il secondo contributo e' invece di tipo energetico: lo stato in questione potrebbe corrispondere ad un minimo di energia potenziale (contributo entalpico). In genere nei sistemi termodinamici macroscopici l'uno o l'altro di questi due contributi prevale e noi ne consideriamo uno solo; ma entrambi sono attivi. Consideriamo il seguente esempio: prendiamo due palline e lasciamole cadere sul pavimento della stanza in cui ci troviamo. Il risultato sara' di avere le palline per terra ad una certa distanza l'una dall'altra (anziche' raggruppate). Le palline cadono per terra per ragioni entalpiche: per terra significa in basso, cioe' in corrispondenza di un minimo dell'energia potenziale gravitazionale. Le palline si disperdono per ragioni entropiche: e' improbabile che cadano e rotolino entrambe nello stesso punto, ed e' invece piu' probabile che rotolino casualmente la prima in una direzione, la seconda in un'altra.
Nella chimica, l'entalpia e' l'energia che puo' essere assorbita o rilasciata in una reazione, in genere sotto forma di calore, ma occasionalmente anche sotto forma di radiazioni elettromagnetiche. Quando i legami (forti o deboli) si formano viene emesso calore, mentre calore viene assorbito quando i legami vengono rotti. Negli stati condensati della materia (liquido e solido) vi sono legami intermolecolari che si formano con emissione di energia e che non possono essere rotti se non fornendo calore (si veda piu' avanti, il calore latente del cambiamento di stato).
L'entropia e' invece una misura della probabilita' dello stato considerato. Per chiarire questo concetto dobbiamo definire quello di microstato termodinamico. Il microstato e' una certa disposizione del sistema, precisamente definita: cioe' ogni microstato corrisponde ad una precisa disposizione spaziale delle molecole che compongono il sistema, ciascuna con una sua posizione istantanea, velocita' e direzione. Ovviamente moltissimi microstati corrispondono al macrostato gassoso, perche' nel gas le molecole si muovono caoticamente e ad ogni istante cambiano posizione e ad ogni urto anche velocita' e direzione. Gli stati condensati invece possiedono un minor numero di microstati, perche' le molecole sono sempre molto vicine tra loro e nel caso dei solidi sono anche fissate in posizioni specifiche da interazioni intermolecolari stabili. Lo stato termodinamico piu' probabile e' quello che corrisponde al maggior numero di microstati e la relazione tra l'entropia e la numerosita' dei microstati e' data dalla legge di Boltzmann:
dove S e' l'entropia, k e' la costante di Boltzmann (1,38 x 10-16 erg/grado) e W la numerosita' dei microstati che corrispondono al macrostato considerato (a livello macroscopico questo termine e' proporzionale alla probabilita' del macrostato, intesa come il rapporto tra il numero dei microstati che corrispondono a quel macrostato e il numero totale dei microstati accessibili al sistema). Quanto piu' lo stato di aggregazione e' disperso (gas piu' di liquido e liquido piu' di solido) tanto maggiore e' il numero di microstati che gli sono accessibili; di conseguenza l'entropia favorisce i gas rispetto ai liquidi e i liquidi rispetto ai solidi.
Vale la seguente regola generale: i sistemi termodinamici tendono a minimizzare la loro energia potenziale (entalpia) e a massimizzare la loro entropia.
ENTROPIA E DISORDINE. Spesso ci si riferisce all'entropia con il termine pittoresco di "disordine". Gli stati condensati sono "ordinati" in quanto nota la posizione di una molecola sono note con approssimazione anche quelle delle altre molecole: ad esempio in un liquido le molecole sono tra loro vicine al limite del contatto (anche se si muovono le une rispetto alle altre). Esiste cioe' una regola che stabilisce quali sono i microstati possibili del sistema. Per contro i gas sono disordinati in quanto nessuna regola stabilisce quali siano i microstati possibili e nota la posizione di una molecola e' impossibile conoscere o ipotizzare quella delle altre. Consegue a questa considerazione che gli stati disordinati hanno un maggior numero di microstati (e quindi una maggiore entropia) degli stati ordinati.
Quasi tutti i liquidi che incontriamo in natura sono costituiti da molecole ben definite che contraggono tra loro interazioni deboli (per contro solo alcuni dei solidi piu' comuni sono costituiti in modo simile). Le interazioni hanno energia simile all'energia cinetica delle molecole e pertanto si rompono e si formano in continuazione, impedendo la formazione di aggregati plurimolecolari stabili. L'acqua liquida e' un buon esempio di questa condizione: le molecole sono aggregate in gruppi di decine o centinaia, definiti con termine inglese "clusters" (grappoli, gruppi), che si formano e scompaiono alquanto rapidamente. Come conseguenza del fatto che le interazioni intermolecolari sono costantemente rotte e riformate, le molecole del liquido possono muoversi le une rispetto alle altre e il liquido non ha forma definita; pero' poiche' le molecole non si allontanano le une dalle altre il liquido ha un volume definito.
I solidi sono corpi con forma e volume definiti. I solidi piu' tipici hanno struttura cristallina e si presentano come corpi con forma propria, di mirabile regolarita' geometrica: si pensi ad esempio al diamante, ed in genere alle pietre preziose, o al cloruro di sodio (il comune sale da cucina, che forma cristalli cubici o a forma di parallelepipedo). La forma di un solido cristallino non e' casuale ma riflette la disposizione spaziale ordinata delle molecole o degli atomi che lo costituiscono: le particelle infatti sono orientate nello spazio dai legami che si stabiliscono tra loro e che dipendono dalla loro forma. La disposizione delle particelle nello spazio costituisce il reticolo cristallino tridimensionale.
Esistono tre tipi di cristalli piu' un quarto tipo meno regolare, caratteristico dei metalli:
SOLIDI COVALENTI nei quali i nodi del reticolo sono occupati da atomi e le maglie sono legami covalenti. La fusione del cristallo richiede di rompere legami covalenti e pertanto avviene solo a temperature elevate. Un esempio di solido di questo tipo e' il diamante (si veda la sua struttura nella lezione sui composti elementari), con punto di fusione a 4000 gradi C.
SOLIDI IONICI, nei quali i nodi del reticolo sono occupati da ioni ed i legami sono legami ionici. E' il caso di molti sali tra i quali il cloruro di sodio (sale da cucina) che ha punto di fusione 600 gradi C.
SOLIDI MOLECOLARI, nei quali i nodi del reticolo sono occupati da molecole ed i legami sono legami deboli. Un esempio e' dato dal ghiaccio che fonde a zero gradi C.
SOLIDI METALLICI. Nei metalli si forma un reticolo piu' o meno regolare (in genere piu' disordinato che nei casi precedenti) nel quale i nodi sono occupati da ioni positivi del metallo mentre le maglie sono costituite da orbitali di legame. Poiche' la caratteristica dei metalli e' quella di essere poveri di elettroni nel loro livello esterno, non tutti gli orbitali di legame che si formano sono stabilmente occupati da elettroni ed anzi i pochi elettroni disponibili saltano costantemente da un orbitale all'altro. Una conseguenza di questa particolare struttura e' che gli elettroni di un metallo possono spostarsi se alle estremita' del corpo vengono applicati degli elettrodi (cioe' i metalli sono buoni conduttori di elettricita'); un'altra e' che molti elettroni non sono accoppiati in orbitali e quindi il metallo e' paramagnetico.
Pochi solidi hanno interesse in medicina, e questi sono prevalentemente solidi ionici quali: il fosfato di calcio, che costituisce la matrice minerale dell'osso; l'ossalato di calcio, che costituisce circa il 90% dei calcoli urinari; e il carbonato di calcio che si forma in alcune condizioni patologiche quali la nefrocalcinosi. Hanno inoltre interesse per la medicina alcuni solidi molecolari responsabili di calcolosi urinarie o biliari: ad esempio i cristalli di acido urico (nella gotta), di bilirubina (nella calcolosi biliare) e di cisteina (nella cistinuria).
SOLIDI AMORFI. Esistono in natura corpi all'apparenza solidi (cioe' dotati di forma e volume propri), ma privi di una vera struttura cristallina. Questi sono definiti solidi amorfi e assomigliano piuttosto a liquidi molto viscosi che a cristalli. Ne sono esempi il vetro e la cera. Non hanno interesse per la medicina.
Ogni sistema termodinamico contiene materia, cioe' uno o piu' composti chimici variamente mescolati. Dal punto di vista delle proprieta' chimiche e fisiche ha importanza se i composti presenti si trovano in un solo stato di aggregazione o in piu' di uno e, se esistono composti allo stato solido, se questi si trovano in un unico corpo o in piu' corpi distinti. Questo perche' alcuni fenomeni (conduzione elettrica, reazioni chimiche, etc.) sono possibili solo se le molecole si trovano in reciproco contatto. Ogni corpo che consente un contatto almeno indiretto tra le molecole che lo compongono costituisce una fase termodinamica.
Ad esempio un bottiglia d'acqua tappata contenente un cubetto di ghiaccio ospita una sola sostanza ripartita tra tre fasi termodinamiche: l'acqua liquida; l'acqua in fase di vapore sopra il liquido (mista ad aria); l'acqua solida nel cubetto di ghiaccio. Se a questo sistema aggiungiamo un altro cubetto di ghiaccio le fasi diventano quattro (perche' ogni cubetto fa fase a se). Una miscela di gas (ad es. l'aria che respiriamo) costituisce un'unica fase termodinamica, e lo stesso si puo' dire di due liquidi miscibili (ad es. acqua e alcol); per contro due liquidi immiscibili (ad es. acqua e olio) formano due fasi termodinamiche.
Consegue a quanto detto a proposito della relazione tra energia cinetica delle molecole ed energia delle interazioni deboli che esse possono formare, che ogni sostanza puo' trovarsi in uno qualunque dei tre stati di aggregazione a seconda della temperatura e della pressione. Infatti poiche' le energie delle interazioni deboli sono sostanzialmente indipendenti dalla temperatura mentre le energie cinetiche dipendono dalla temperatura, a temperature sufficientemente basse le interazioni deboli dovranno prevalere sull'energia cinetica e la sostanza sara' solida, mentre a temperature elevate dovra' prevalere l'energia cinetica e la sostanza sara' gassosa. Ovviamente bassa ed alta temperatura in questo contesto sono termini generici ed imprecisi: per l'acqua una temperatura di 20 gradi centigradi e' bassa e la sostanza e' liquida perche' le interazioni intermolecolari sono piuttosto energiche (legami idrogeno); per l'azoto la stessa temperatura e' molto alta perche' le interazioni intermolecolari sono debolissime (forze di Van Der Waals tra molecole molto piccole). Esiste un parametro che ci chiarisce quale sia una temperatura alta o bassa per ogni sostanza, il suo punto critico. Il punto critico (diverso e caratteristico per ogni sostanza) e' la temperatura al di sopra della quale il gas non puo' essere liquefatto per compressione.
I cambiamenti di stato ai quali le sostanze vanno incontro a seguito di variazioni della temperatura o della pressione prendono i seguenti nomi:
solido --> liquido: fusione
liquido --> solido: solidificazione
liquido --> gas: evaporazione (ebollizione)
gas --> liquido: liquefazione
solido --> gas: sublimazione
gas --> solido: brinamento
DIAGRAMMI DI STATO sono grafici che riportano lo stato di aggregazione di una sostanza in funzione della temperatura (in ascissa) e della pressione (in ordinata). Il piano del diagramma di stato e' diviso in tre aree (condizioni di temperatura e pressione nelle quali prevale un solo stato di aggregazione) da tre linee (sui punti delle quali si ha l'equilibrio tra due stati che quindi coesistono: ad esempio nelle condizioni di temperatura e pressione del punto 1 della fig.6 il gas e' in equilibrio con il solido; in quelle del punto 2 il solido e' in equilibrio con il liquido; etc.); le tre linee si uniscono in un punto definito il punto triplo, in corrispondenza del quale si ha l'equilibrio di tutti e tre gli stati di aggregazione. Quando si attraversa una linea in orizzontale (variazione di temperatura a pressione costante) o in verticale (variazione di pressione a temperatura costante) si ha un cambiamento di stato.
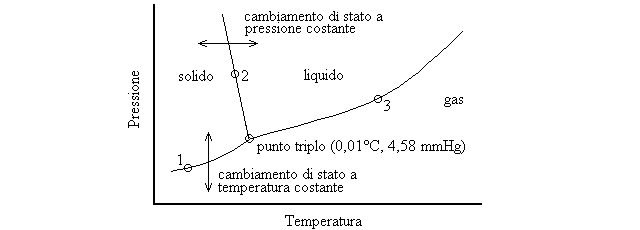
Figura 6: il diagramma di stato dell'acqua
CALORE LATENTE DEL CAMBIAMENTO DI STATO. Se un corpo viene riscaldato, si osserva che la sua temperatura aumenta soltanto quando non si ha cambiamento di stato; nel corso del cambiamento di stato il corpo assorbe calore a temperatura costante. Il calore assorbito durante il cambiamento di stato si chiama calore latente. Si immagini il seguente esperimento: un cubetto di ghiaccio e' posto in un recipiente chiuso con un pistone (quindi il volume e' variabile e la pressione e' costante, supponiamo a 1 atm); nel recipiente si puo' misurare la temperatura del ghiaccio mediante un termometro. Si accende ora una sorgente di calore sotto il recipiente, che fornisce una quantita' costante di calore e si determinano il calore fornito e la temperatura del ghiaccio. Inizialmente il ghiaccio viene riscaldato. Quando la temperatura arriva a zero gradi si osserva che il ghiaccio inizia a fondere ma la sua temperatura non aumenta, sebbene il fornello continui a fornire calore. Quando la fusione e' completa il recipiente contiene una sola fase termodinamica (acqua a zero gradi) e solo allora la temperatura riprende a salire. Quando la temperatura raggiunge i 100 gradi l'acqua prende a bollire a la temperatura smette di salire. Ad un certo punto tutta l'acqua si sara' trasformata in vapore a 100 gradi e da quel punto in poi la temperatura riprende a salire (fig. 7).
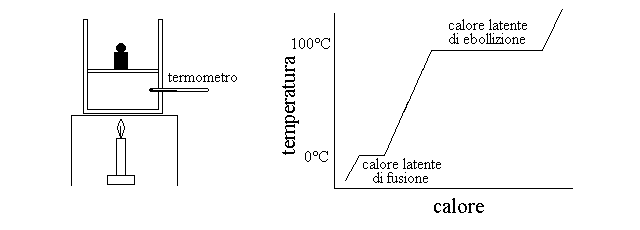
Figura 7: Calore latente del cambiamento di stato. A sinistra: raffigurazione dell'esperimento; a destra: grafico dell'aumento di temperatura in funzione del calore fornito.
Il calore latente del cambiamento di stato corrisponde all'energia assorbita per rompere i legami deboli intermolecolari (o ceduta nel corso della loro formazione). Ad esempio il calore latente di evaporazione dell'acqua e' di 540 cal/g che per un peso molare di 18 g/mole corrisponde a 9,7 kcal/mole. Considerando che ogni molecola d'acqua forma al massimo due legami idrogeno, questo valore suggerisce che l'energia del legame idrogeno nell'acqua e' di circa 5 kcal/mole.
ASPETTI MEDICI DEL CALORE LATENTE DEL CAMBIAMENTO DI STATO. Il calore latente del cambiamento di stato ha una importante conseguenza per la fisiologia dell'organismo. Il metabolismo del nostro corpo produce calore e questo calore mantiene la nostra temperatura a circa 36,5 gradi. Quando l'ambiente e' piu' freddo del nostro corpo l'eccesso di calore prodotto dal metabolismo viene disperso e se necessario il metabolismo viene aumentato allo scopo di mantenere costante la temperatura corporea. Quando l'ambiente e' piu' caldo del nostro corpo, il calore metabolico e quello ambientale tenderebbero ad elevare la nostra temperatura corporea al di sopra dei valori normali. L'organismo reagisce con la sudorazione, secrezione di acqua e sali attraverso le ghiandole sudoripare della cute. L'evaporazione del sudore sottrae alla cute il calore latente dell'evaporazione dell'acqua e ci consente di disperdere il nostro calore metabolico anche a fronte di temperature ambientali maggiori di quelle del corpo. Gli animali che non possiedono ghiandole sudoripare (ad es. il cane) disperdono il calore in un modo meno efficiente ansimando, grazie all'evaporazione della saliva.
(riveduto ott. 2012)
Torna a: didattica; Medicine non Scientifiche; Biblioteca Digitale.