PRIMA FACOLTA' DI MEDICINA E CHIRURGIA - CLM "B"
SAPIENZA UNIVERSITA' DI ROMA
Il legame chimico e' un orbitale (orbitale di legame) che si forma a seguito della sovrapposizione e fusione degli orbitali di due atomi quando quiesti si trovano a brevissima distanza l'uno dall'altro. Perche' il legame sia stabile non e' sufficiente che si formi l'orbitale di legame, ma occorre anche che questo sia popolato da elettroni. Come per gli orbitali atomici, anche per gli orbitali di legame vale il principio di esclusione di Pauli e quindi un orbitale di legame puo' essere popolato al massimo da due elettroni con spin opposto. In genere i due atomi che che devono formare il legame possiedono ciascuno un orbitale contenente un solo elettrone; a seguito della fusione dei due orbitali atomici, l'orbitale di legame e' abitato da due elettroni derivanti ciascuno da uno o dall'altro dei due atomi che formano il legame. Un legame del tipo ora descritto si chiama covalente e si dice che gli elettroni che abitano l'orbitale di legame sono messi in comune tra i due atomi.
L'orbitale di legame, trovandosi nello spazio compreso tra due nuclei atomici costituisce una regione dello spazio nel quale il campo elettrostatico nucleare e' particolarmente intenso e quindi ha energia minore (e' piu' stabile) degli orbitali atomici che hanno contribuito a formarlo. Gli elettroni che si trasferiscono dagli orbitali atomici all'orbitale di legame cadono quindi in una buca di potenziale e la formazione del legame e' invariabilmente associata ad emissione di energia.
L'orbitale di legame di tipo σ (sigma) e' il piu' semplice e quello a minor energia; e' quindi necessariamente presente quando due atomi si combinano insieme. Esso presenta la massima densita' elettronica sulla linea immaginaria che congiunge i nuclei dei due atomi costituenti ed ha una forma ovoidale, che include i nuclei degli atomi coinvolti ai suoi poli. Qualunque orbitale atomico e' idoneo a formare un orbitale di legame di tipo σ.
Ad esempio nel caso del legame tra i due atomi di idrogeno che formano la molecola di questo gas, si osserva quanto segue: ciascun atomo ha un solo elettrone nell'orbitale 1s; la sovrapposizione e fusione dei due orbitali 1s produce un orbitale di legame di tipo σ nel quale trovano posto i due elettroni che negli atomi isolati erano spaiati; qualunque fosse il loro spin negli orbitali atomici, una volta trasferiti nell'orbitale di legame i due elettroni assumono spin diverso (+1/2 e -1/2).
La distanza tra i nuclei degli atomi che contraggono un legame chimico e' caratteristica di quel particolare legame e dipende dalla forma e dall'energia degli orbitali atomici coinvolti; essa prende il nome di distanza di legame.
In un legame di tipo σ, la zona nella quale e' massima probabilita' di trovare gli elettroni si trova sempre sulla linea che congiunge i due nuclei (area di massima densita' elettronica). Quando i due atomi che si legano tra loro sono uguali (ad es. H-H o Cl-Cl), ed hanno quindi uguale tendenza ad attrarre gli elettroni di legame, l'orbitale σ e' perfettamente simmetrico e l'area di massima densita' elettronica si trova esattamente a meta' strada tra i due nuclei. Un legame di questo tipo si chiama covalente omopolare (o anche omeopolare). Quando invece il legame si forma tra due atomi diversi, che hanno diversa tendenza ad attrarre gli elettroni (ad es. H-Cl), l'area di massima densita' elettronica e' spostata verso l'atomo che ha maggiore tendenza ad attrarre gli elettroni (l'atomo piu' elettronegativo) e l'orbitale assume la forma di un uovo di gallina, con una estremita' piu' grande ed una piu' sottile. Questo tipo di legame si chiama covalente eteropolare o piu' semplicemente polare.
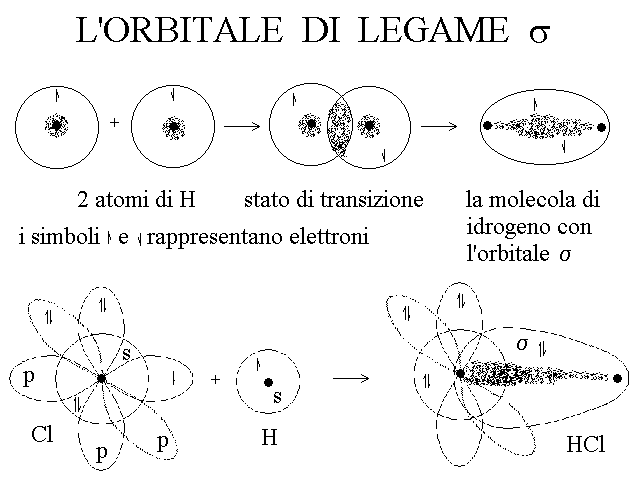
Figura 1: il legame σ covalente omopolare di H2 e quello covalente eteropolare di HCl.
STABILITA' DEL LEGAME CHIMICO. Si puo' osservare che a seguito della formazione del legame chimico nella molecola dell'idrogeno ciascun atomo si trova a condividere due elettroni invece di possederne per intero uno solo. In questo modo nell'idrogeno molecolare ciascun atomo approssima la configurazione elettronica esterna dell'elio, il gas nobile che segue l'idrogeno nella tavola periodica. Questa affermazione e' generalizzabile: ad esempio il fluoro forma anch'esso una molecola biatomica nella quale due atomi identici, con configurazione elettronica esterna 2s22p5, sovrappongono l'orbitale 2p contenente un solo elettrone spaiato e formano un orbitale di legame σ che contiene due elettroni. Sommando gli elettroni propri e condivisi, ciascun atomo di fluoro nella molecola di F2 raggiunge la configurazione elettronica del neon, il gas nobile che segue il fluoro nella tavola periodica.
ENERGIA DI LEGAME. L'energia di legame tiene uniti i due atomi che formano l'orbitale di legame ed e' uguale nel modulo, ma opposta nel segno, all'energia che e' necessario fornire per rompere il legame stesso. Ad esempio:
Il simbolo H* indica l'atomo di idrogeno con il suo unico elettrone spaiato e si legge Hpunto. L'equazione ci mostra che la formazione di un grammo di idrogeno molecolare allo stato gassoso, a partire da un grammo di atomi isolati, si associa alla liberazione di 52 kcal di energia. Rompere il legame e separare i due atomi della molecola richiede che sia fornita dall'esterno la stessa quantita' di energia. L'emissione dell'energia nel corso della formazione del legame e' spiegata dal fatto che l'orbitale σ ha una energia potenziale piu' bassa di quella degli orbitali atomici 1s (si trova tra due nuclei in una regione in cui il loro campo elettrostatico si somma).
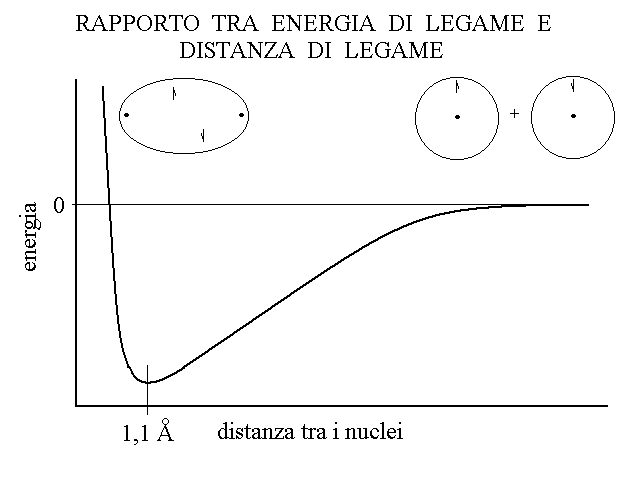
Figura 2: L'energia di legame rispetto alla distanza tra i nuclei.
Da dove viene l'energia di legame? Quando i due nuclei degli atomi tra i quali il legame si stabilisce si trovano alla distanza necessaria alla sovrapposizione degli orbitali esterni, il campo elettrostatico di ciascuno si sovrappone parzialmente a quello dell'altro e nelle aree di sovrapposizione diventa molto intenso. Questo comporta che l'orbitale di legame abbia una energia minore di quella degli orbitali atomici e, di conseguenza, che la disposizione degli elettroni in un orbitale di legame sia piu' stabile di quella degli orbitali atomici di provenienza: l'orbitale di legame costituisce per gli elettroni una "buca" di potenziale. Come conseguenza la formazione di un legame chimico a partire dagli atomi isolati e' sempre ed invariabilemnte associata ad emissione di energia: cioe' lo stato legato e' necessariamente piu' stabile di quello legato.
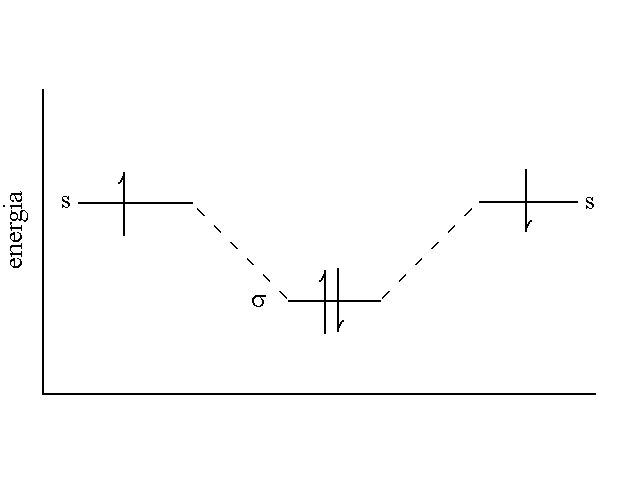
Figura 3: Energia degli orbitali 1s dell'idrogeno atomico e σ dell'idrogeno molecolare (H2). Le freccioline rappresentano gli elettroni, che quando sono accoppiati nell'orbitale di legame hanno necessariamente spin opposto.
La grande stabilita' degli stati legati degli atomi, rispetto agli stati non legati, fa si che gli atomi isolati in natura, nelle condizioni di temperatura e pressione della superficie terrestre, siano molto rari: gli atomi si trovano sempre combinati in molecole. Fanno eccezione i gas nobili (VIII gruppo della tavola periodica) che hanno tutti gli orbitali del livello elettronico esterno saturi di elettroni e non formano affatto legami chimici.
Una conseguenza della condizione descritta e' che, a meno di condizioni di laboratorio alquanto particolari o di ambienti inusuali (stelle, altri pianeti), le reazioni chimiche non avvengano tra atomi ma tra molecole e che perche' esse avvengano alcuni legami debbano essere rotti prima che altri possano essere formati.
ORBITALE ANTI-SIGMA (σ*). Gli orbitali non si consumano e quando due orbitali atomici (qualsiasi) si fondono per dare origine all'orbitale di legame σ, si viene contemporaneamente a formare anche un altro orbitale molecolare chiamato di anti-legame o anti-sigma (σ*). L'orbitale di anti-legame ha energia maggiore non solo dell'orbitale di legame ma anche degli orbitali atomici da cui deriva e se viene popolato di elettroni questo porta in genere alla rottura del legame e alla separazione dei due atomi. Di norma l'orbitale di anti-legame non e' popolato di elettroni, ma puo' esserlo occasionalmente a seguito dell'irraggiamento della molecola con radiazioni elettromagnetiche di opportuna lunghezza d'onda, spesso UV o X a bassa frequenza (X "vicino"). Si realizza in questi casi uno stato eccitato della molecola, analogo agli stati eccitati descritti per gli atomi isolati.
E' gia' stato osservato che quando un orbitale di legame si forma tra due atomi uguali e' perfettamente simmetrico ed il legame che si forma e' definito covalente omopolare (o omeopolare o non polare). Quando invece l'orbitale di legame si forma tra due atomi diversi, ciascuno attira gli elettroni di legame verso di se in misura dipendente dalla sua carica nucleare e dallo schermo formato dagli elettroni interni. La capacita' di ogni atomo di attrarre su di se gli elettroni di legame e' chiamata elettronegativita' ed e' stata gia' considerata nelle lezioni dedicate alla struttura e alle proprieta' dell'atomo. Come conseguenza della diversa elettronegativita', gli elettroni di legame si trovano piu' vicino ad uno dei due atomi che all'altro e l'orbitale di legame si deforma e diventa asimmetrico (Fig.1). In questo caso il legame e' definito covalente eteropolare o, piu' semplicemente, polare. Nel caso dei legami covalenti polari l'energia di legame acquista una componente aggiuntiva, non considerata nella discussione precedente.
La maggiore densita' di carica negativa sul piu' elettronegativo dei atomi che formano il legame (e la maggiore densita' di carica positiva sull'altro) fanno si che una molecola polare biatomica abbia la struttura di un dipolo, con una estremita' negativa e l'altra positiva. In conseguenza della parziale separazione di carica (parziale perche' non corrisponde al possesso stabile di un elettrone, ma soltanto alla sua maggiore vicinanza al nucleo), tra le due estremita' del dipolo si stabilisce una attrazione elettrostatica che va a sommarsi all'energia di legame dovuta alla buca di potenziale costituita dalla minore energia dell'orbitale di legame.
Nonostante la presenza di questo secondo contributo, elettrostatico, all'energia di legame, il legame covalente eteropolare non e' necessariamente piu' stabile di quello omopolare perche' la deformazione dell'orbitale di legame diminuisce la profondita' della buca di potenziale dovuta alla minore energia dell'orbitale di legame.
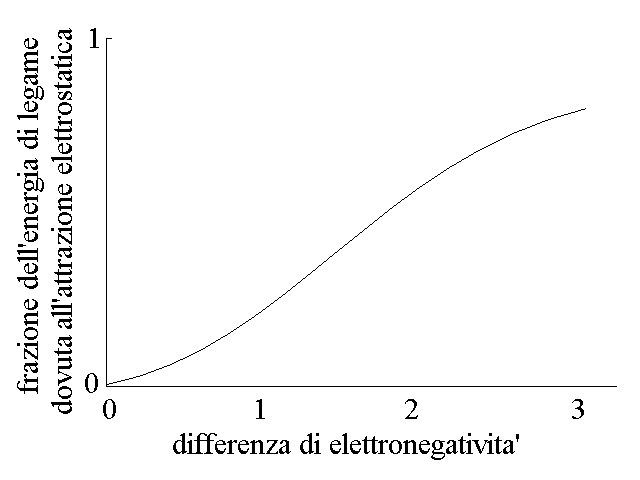
Figura 4: Frazione dell'energia di legame dovuta all'attrazione elettrostatica.
E' possibile graficare la componente dell'energia di legame dovuta all'attrazione elettrostatica in funzione della differenza di elettronegativita' tra i due atomi che formano il legame (Fig.4). Se si fa questo si osserva che quando la differenza di elettronegativita' tra i due atomi e' superiore a 2 unita' sulla scala di Pauling (la piu' usata), la componente dei attrazione elettrostatica diventa prevalente ed il legame si definisce IONICO perche' la molecola assomiglia ad una coppia di ioni di segno opposto tenuti insieme dall'attrazione elettrostatica.
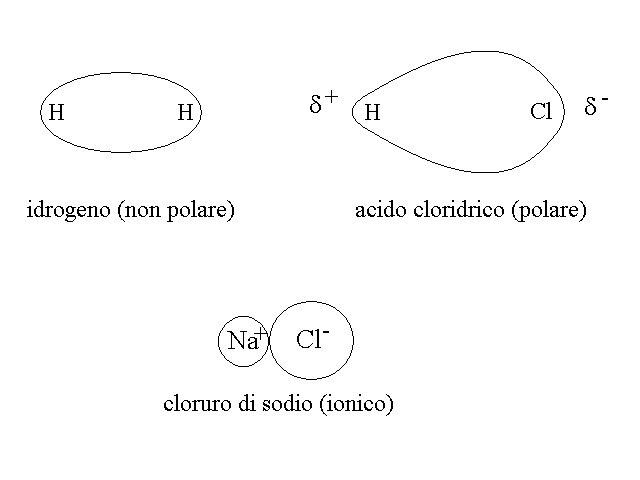
Figura 5: Esempi di molecole biatomiche con legami covalente omopolare, covalente eteropolare e ionico (in realta' la molecola della sostanza ionica NaCl non e' mai formata in modo netto come quello rappresentato in figura, ma e' immersa in un reticolo cristallino nel quale si confonde con altre molecole simili, come descritto piu' avanti).
Se una sostanza ionica viene disciolta in acqua, il legame ionico si indebolisce a causa del coefficiente dielettrico di quest'ultima e le molecole della sostanza si separano in coppie di ioni di segno opposto.
Puo' accadere che due atomi che si trovano a distanza di legame si dispongano in modo tale da sovrapporre piu' di un solo orbitale. Questo pero' accade soltanto se tutti gli orbitali che si sovrappongono contengono un solo elettrone ciascuno. Ad esempio due atomi di ossigeno, con configurazione elettronica esterna 2s22p4, possiedono ciascuno due orbitali p occupati da un elettrone spaiato e possono sovrapporli entrambi, uno frontalmente con il suo omologo dell'altro atomo, l'altro lateralmente. Questo porta alla formazione di due orbitali di legame occupati ciascuno da due elettroni:
Tra due atomi puo' stabilirsi un solo orbitale di legame di tipo σ l'eventuale secondo orbitale di legame e' definito π (pi greco) ed ha una forma diversa: possiede due lobi con le aree di massima densita' elettronica sopra e sotto (o davanti e dietro) all'orbitale σ.
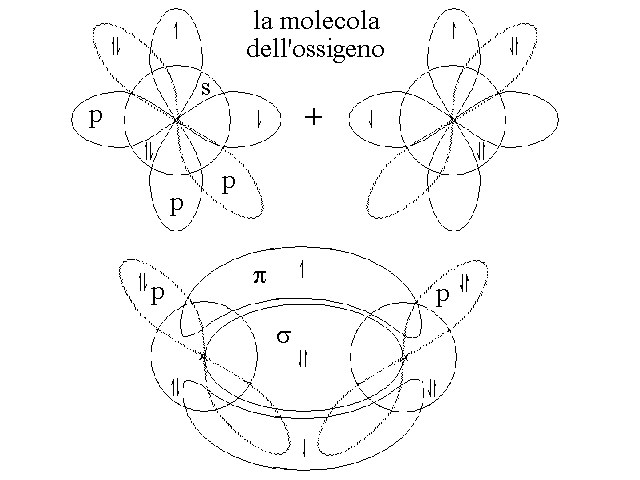
Figura 5: Gli orbitali σ e π nella molecola dell'ossigeno.
In alcuni casi si verifica la sovrapposizione di tre coppie di orbitali atomici, tutti contenenti elettroni spaiati; questo accade ad esempio nell'azoto, cha ha lastruttura elettronica esterna 2s22p3. Soltanto una coppia di orbitali atomici puo' sovrapporsi in direzione frontale e formare un orbitale di legame di tipo σ le altre due coppie di orbitali atomici si sovrappongono lateralmente e formano due orbitali di legame di tipo π, orientati a 90 gradi uno dall'altro e quindi con i lobi rispettivamente sopra/sotto e davanti/dietro all'orbitale σ.
Una coppia di atomi non puo' formare piu' di tre orbitali di legame, un σ e due π.
Qualunque orbitale atomico puo' formare un orbitale di legame di tipo σ, mentre soltanto orbitali bilobati (p) possono formare orbitali di legame di tipo π. Pertanto la presenza ed il numero degli orbitali π in una molecola ci informa sull'eventuale ibridazione degli orbitali atomici negli atomi che contraggono il legame. Ad esempio la molecola di N2, che contiene due orbitali atomici di tipo π non e' compatibile con le ibridazioni sp3 o sp2, ed e' compatibile con l'ibridazione atomica di tipo sp, l'unica che lascia due orbitali p non ibridati, idonei a formare i due orbitali di legame π.
RAPPRESENTAZIONE DI LEWIS DEL LEGAME CHIMICO. In un legame covalente gli atomi tendono a completare il riempimento degli orbitali del livello elettronico esterno; in genere questo porta ad una configurazione ad 8 elettroni (ottetto, con gli orbitali s e p dell'ultimo livello saturi di elettroni, siano essi orbitali atomici o fusi in orbitali di legame). La configurazione ad 8 elettroni e' anche quella dei gas nobili e pertanto si dice che gli atomi nel formare legami approssimano la configurazione elettronica esterna dei gas nobili.
Il grande chimico C. Lewis (attivo nella prima meta' del '900) propose una rappresentazione degli atomi e dei legami che rendesse conto di queste proprieta', indicando gli elettroni con puntini, in coppie se presenti nello stesso orbitale, isolati altrimenti. In questa rappresentazione un legame chimico e' una coppia di puntini a meta' tra due atomi e un doppio legame due coppie di puntini: ad esempio H:H; O::O; N:::N. E' anche possibile (e forse piu' chiara) una rappresentazione di Lewis modificata, nella quale il legame e' rappresentato come un trattino teso tra due puntini (elettroni).
OTTETTO E VALENZA: due concetti antiquati ma non inutili.
Poiche' gli atomi tendono a formare tutti i legami possibili con i loro elettroni spaiati, e poiche' molti composti derivano da atomi dei primi periodi della tavola periodica , che possono accogliere al massimo 8 elettroni nel loro livello leettronico esterno, nelle molecole molti atomi tendono a circondarsi con 8 elettroni (ottetto), sommando quelli prorpi e quelli condivisi. Questo e' reso evidente nelle formule di Lewis.
Il numero di legami che l'atomo forma per completare il suo ottetto (o il numero di elettroni che cede o acquista in questi legami) e' definito valenza. Ad esempio l'ossigeno ha 6 elettroni nel suo livello esterno (con n=2) e deve acquistarne 2 per raggiungere l'ottetto. Poiche' in genere per acquistare due elettroni deve formare due legami, l'ossigeno e' bivalente. Quando si considerano composti nei quali appaiono legami dativi, nei quali un solo atomo cede o acquista due elettroni, il concetto di valenza diventa complicato e un po' paradossale; probabilmente in questi casi e' meglio non utilizzarlo.
Le molecole considerate finora erano biatomiche, cioe' costituite da due soli atomi: ad es. H2, N2, O2, HCl etc. Fermo restando che il legame chimico si stabilisce sempre e soltanto tra due atomi adiacenti, esistono pero' molecole composte da tre o piu' atomi ed il numero di atomi che possono trovarsi legati nella stessa molecola e' virtualmente illimitato. Quando si scrivono le formule e' importante ricordare che il legame chimico unisce sempre due atomi e non di piu' e che pertanto le molecole poliatomiche contengono molti legami che uniscono coppie di atomi. Ad esempio nella molecola d'acqua H2O, ciascun atomo di idrogeno contrae un legame covalente con l'ossigeno (di tipo σ) e i tre atomi sono legati nella catena H-O-H.
Puo' accadere che il legame si stabilisca tra due atomi dei quali uno fornisce un orbitale abitato da due elettroni e l'altro un orbitale vuoto. Un legame di questo tipo e' definito covalente dativo e si instaura solo se l'atomo che dona la coppia di elettroni ha gia' impegnato in altri legami i suoi elettroni spaiati. Ad esempio:
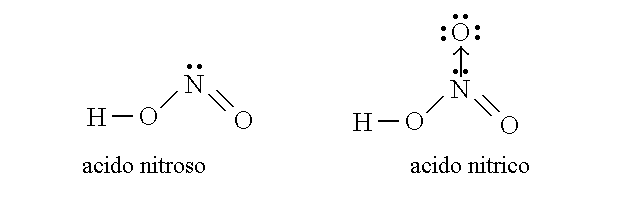
Figura 6: le formule dell'acido nitroso (che non possiede legami dativi) e dell'acido nitrico (che possiede un legame dativo indicato in figura con una freccia).
Nella molecola dell'acido nitrico l'azoto contrae due legami semplici (con un orbitale di tipo σ) e un legame doppio (con un orbitale di tipo σ e uno di tipo π). Una volta che i legami si sono formati, pero' non e' piu' possibile distinguere quali siano singoli e quale sia doppio: gli atomi dell'azoto e dell'ossigeno si dispongono a distanze ed in posizioni intermedie tra quelle del legame semplice e quelle del legame doppio e gli elettroni dell'orbitale π (ma non quelli degli orbitali σ) si muovono tra N e i tre O. Una situazione di questo genere viene definita di delocalizzazione dell'orbitale π.
Fenomeni di delocalizzazione sono frequenti nelle molecole che presentano legami dativi, ma non sono confinati a queste: ad esempio la delocalizzazione e' presente nel benzene (C6H6) che non presenta legami dativi. Inoltre la delocalizzazione e' assente in tutti i casi nei quali la molecola non contiene doppi legami (infatti si delocalizzano soltanto gli orbitali di tipo π); pertanto i legami dativi che intervengono in molecole prive di doppi legami (ad es. nello ione ammonio NH4+) non danno luogo a fenomeni di delocalizzazione.
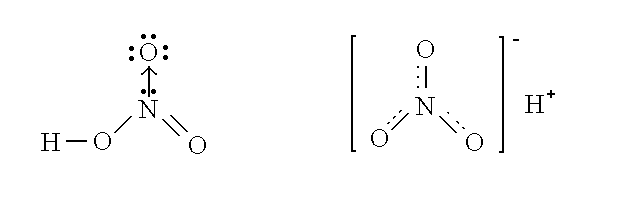
Figura 7: Una rappresentazione della molecola dell'acido nitrico che non tiene conto della delocalizzazione (a sinistra) e una che ne tiene conto (a destra).
La delocalizzazione e' possibile quando la disposizione degli orbitali di legame π di una molecola puo' essere alterata senza alterare le posizioni degli atomi e comporta che i nuclei atomici vibrino introno a posizioni "medie" mentre gli orbitali di legame π si spostano rapidamente tra le varie posizioni possibili occupandole di fatto tutte, anche se in modo parziale. Un modo alternativo per indicare questa condizione e' considerare per ogni molecola capace di delocalizzazione degli orbitali π due o piu' strutture alternative (di risonanza): la struttura "vera" sarebbe allora la media delle strutture di risonanza.
La distanza di legame e' caratteristica di ogni coppia di atomi e di ogni tipo di legame che si formi tra loro (si veda la figura 2). Dalla determinazione sperimentale della distanza di legame (ad es. mediante cristallografia a raggi X) si puo' ipotizzare la natura del legame (singolo, doppio, triplo, doppio in presenza di fenomeni di delocalizzazione).
Quando una molecola e' costituita da piu' di due atomi e' possibile prendere gruppi di tre atomi legati tra loro e determinare l'angolo che si forma tra i tre nuclei; questo parametro si chiama angolo di legame ed e' caratteristico del tipo di legame e dell'ibridazione degli orbitali atomici che si e' resa necessaria per formare il legame stesso. Ad esempio nella molecola d'acqua gli atomi di ossigeno presentano ibridazione sp3 e l'angolo di legame corrisponde all'angolo al centro di un tetraedro distorto (105 gradi anziche' 109):
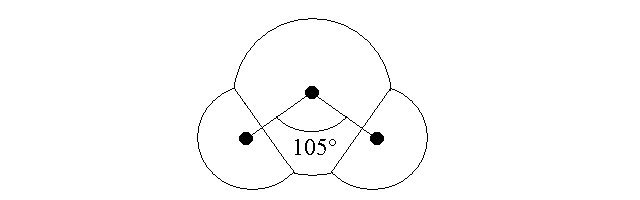
Figura 8: Angolo di legame nella molecola dell'acqua.
A causa dell'elevato valore dell'energia di legame, gli atomi sono molto reattivi e non si trovano come tali in natura: infatti e' energeticamente conveniente per gli orbitali atomici contenenti elettroni spaiati andare incontro alla formazione di orbitali di legame; e perfino gli orbitali atomici contenenti coppie di elettroni possono formare legami di tipo dativo. Come conseguenza, con la notevole eccezione dei gas nobili (VIII gruppo della tavola periodica; in alcune tavole e' indicato come gruppo 0), gli atomi sono presenti in natura combinati tra loro in molecole, piu' o meno complesse, e la materia che ci circonda e' costituita da sostanze o composti, talvolta in forma pura o pressoche' pura, piu' frequentemente in miscugli.
CLASSIFICAZIONE DEI COMPOSTI CHIMICI.
I composti chimici "possibili" sono virtualmente infiniti; per questo motivo una classificazione esaustiva e' impossibile, ed anche una parziale e' complessa; ne daremo qui soltanto alcuni cenni.
La prima dicotomia rilevante e' quella tra i composti che contengono il carbonio e quelli che non lo contengono; i primi sono definiti composti organici, i secondi inorganici. Il motivo di questa dicotomia, apparentemente sproporzionata,risiede nel fatto che il carbonio e' l'unico elemento che puo' combinarsi con se' stesso in misura illimitata; di conseguenza puo' formare molecole molto grandi, numerose e complesse. La chimica del carbonio e' estremamente importante in biologia e in medicina.
I COMPOSTI CHIMICI INORGANICI.
COMPOSTI ELEMENTARI. I composti chimici piu' semplici sono quelli alla cui formula partecipano gli atomi di un solo elemento: questi sono i composti elementari e sono in numero di poco superiore a quello degli elementi stessi perche' ogni elemento ha almeno uno stato elementare e qualcuno ne ha due o piu'. Limitando la nostra analisi ai primi due periodi della tavola periodica, osserviamo che:
1) I gas nobili hanno molecola monoatomica: He, Ne, etc.
2) L'idrogeno (I gruppo) e gli alogeni (VII) gruppo hanno molecole biatomiche: H2, F2, Cl2, etc. La spiegazione di queste strutture e' semplice: gli atomi indicati possiedono un solo orbitale con un elettrone spaiato nello strato piu' esterno (o perche' non possiedono nient'altro, come l'idrogeno, o perche' gli altri orbitali contengono coppie di elettroni), e di conseguenza una coppia di atomi forma un solo orbitale di legame.
3) Il litio e gli altri elementi del I gruppo (ad esclusione dell'idrogeno), il berillio con gli altri elementi del secondo gruppo, ed il boro con gli altri elementi del terzo gruppo formano solidi molecolari con legami di tipo metallico; non e' possibile assegnare una vera formula ad un composto elementare di questo tipo perche' la struttura e' vritualmente illimitata (vedi oltre).
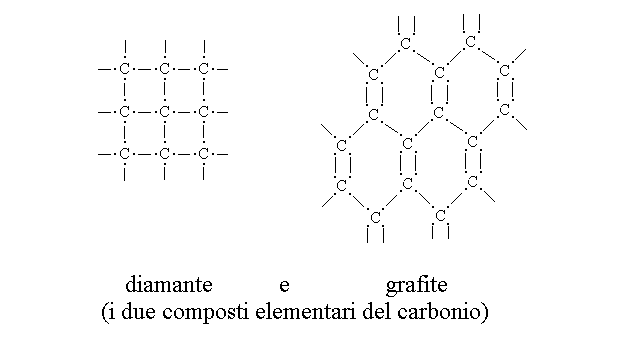
4) Il carbonio ha due stati elementari distinti, il diamante e la grafite. Questi sono entrambi solidi cristallini ma non hanno carattere metallico.
5) L'ossigeno (O2)e l'azoto (N2) formano gas biatomici con le formule seguenti:

COMPOSTI INORGANICI BINARI.
Un composto alla cui molecola partecipano atomi di due elementi diversi e' chiamato binario. Poiche' l'idrogeno e l'ossigeno sono importanti, abbondanti e si combinano con tutti gli elementi della tavola periodica (con l'eccezione del fluoro che si combina con l'idrogeno ma non con l'ossigeno), i composti binari di questi due elementi vengono considerati per primi.
1) COMPOSTI BINARI DELL'IDROGENO: consideriamo l'acqua, l'ammoniaca , gli acidi alogenidrici (nei quali l'idrogeno e' combinato con un elemento del VII gruppo); inoltre gli idrocarburi, composti binari dell'idrogeno con il carbonio, il piu' semplice dei quali e' il metano:
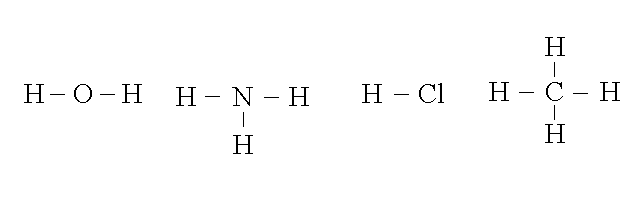
2) COMPOSTI BINARI DELL'OSSIGENO: la nomenclatura chimica moderna divide i composti binari dell'ossigeno in ossidi, perossidi e superossidi. Una nomenclatura piu' antica ma ancora in uso e maggiormente diffusa, distingue gli ossidi in due gruppi: i composti dell'ossigeno con i metalli (ossidi veri e propri) e con i non metalli (anidridi). Questa distinzione e' giustificata dal fatto che il legame chimico negli ossidi metallici e' ionico, quello nelle anidridi covalente polare.
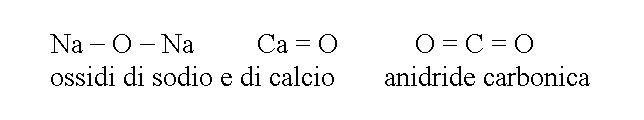
Il MONOSSIDO DI AZOTO (ossido nitrico, NO). L'azoto si combina con l'ossigeno per formare vari ossidi e anidridi, quali il protossido (N2O), il monossido (NO) e l'anidride nitroso-nitrica (NO2). Tra questi il piu' importante per la medicina e' il monossido che e' prodotto da alcune cellule specializzate (endotelio, granulociti) con funzioni di vasodilatatore e di battericida. La configurazione elettronica dello NO e' quella di un radicale stabile: infatti la molecola possiede un elettrone spaiato (si chiama radicale una specie chimica che possiede almeno un elettrone spaiato ed e', di conseguenza, paramagnetica):
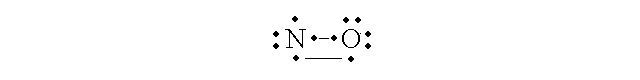
3) COMPOSTI BINARI DI ELEMENTI DIVERSI DALL'IDROGENO E DALL'OSSIGENO costituiscono una categoria residua, quindi per definizione eterogenea. I piu' importanti per la medicina sono gli alogenuri, i sali degli elementi del VII gruppo; tra questi ricordiamo il cloruro di sodio (sale da cucina), e lo ioduro di potassio (che viene aggiunto al sale da cucina per prevenire l'ipotiroidismo da carenza di iodio).
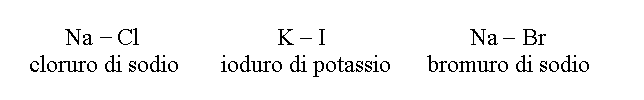
COMPOSTI INORGANICI TERNARI.
I composti alla cui molecola partecipano atomi di tre elementi distinti sono definiti ternari; sono ovviamente molto numerosi. Si noti che la molecola puo' avere piu' di tre atomi, ma la formula sara' sempre del tipo XnYnZn. Sono particolarmente rilevanti per la medicina i composti ternari che comprendono idrogeno, ossigeno ed un terzo elemento. Escludendo per il momento i composti del carbonio, a questa categoria appartengono gli idrossidi, composti nei quali il terzo elemento e' un metallo, e gli ossiacidi, composti nei quali il terzo elemento e' un non-metallo. Due esempi sono i seguenti:
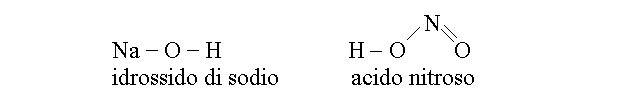
Il peso molecolare (P.M.; M.W.) di un composto e' dato dalla somma dei pesi atomici (P.A.) degli atomi che compaiono nella formula. Ad esempio la molecola dell'acqua, come si deduce dalla formula H2O, e' composta da sue atomi di idrogeno, ciascuno dei quali ha P.A.=1 e da un atomo di ossigeno, che ha P.A.=16; pertanto il peso molecolare risulta P.M. = 2 x 1 + 16=18.
Con il peso molecolare (e atomico) sono definiti la massa molecolare (e atomica). Sulla terra i due parametri coincidono e vengono usati in modo intercambiabile (e talvolta confusi tra loro), ma si deve ricordare che la massa e' una proprieta' fondamentale della materia definita dalla legge F = m x A, mentre il peso e' la forza attrattiva che agisce su quella massa quando essa si trova in un campo gravitazionale. Il peso molecolare e la massa molecolare sono espressi in UMA (unita' di massa atomica) e possono avere valore non intero perche', come gia' osservato il peso (e la massa) atomico e' la media del peso (o della massa) degli isotopi, calcolato tenendo conto delle loro abbondanze relative.
Una volta definiti i nomi dei principali composti della chimica inorganica e' possibile riconsiderare gli elementi della tavola periodica alla luce delle loro proprieta' chimiche e dei composti caratteristici che sono in grado di formare.
Il primo gruppo: idrogeno e metalli alcalini
Gli elementi del primo gruppo della tavola periodica presentano la configurazione elettronica esterna Ns1. Ad esempio H ha la configurazione 1s1, Li ha la configurazione elettronica esterna 2s1, Na ha 3s1, K ha 4s1, etc.
L'idrogeno differisce dagli elementi successivi del suo gruppo perche' il primo livello elettronico puo' contenere due soli elettroni e quindi la configurazione 1s1 risulta equidistante da quelle degli ioni stabili monopositivo H+ e mononegativo H- (ione idruro): si puo' dire che ha alcune caratteristiche dei metalli alcalini e alcune degli alogeni (VII gruppo). Anche la sua elettronegativita' e' intermedia (2,1). Ovviamente e' un caso unico nella tavola periodica.
Gli elementi del I gruppo successivi all'idrogeno hanno valori di elettronegativita' molto bassi (tra 0,7 e 1) e formano legami ionici, cedendo il loro elettrone piu' esterno all'atomo col quale si legano. Composti tipici sono ad esempio: gli ossidi con formula Li2O, Na2O, K2O, etc. e gli alogenuri con formula LiBr, NaCl, KI etc. Poiche' il legame e' ionico, questi composti disciolti in acqua si dissociano negli ioni corrispondenti:
NaCl --> Na+ + Cl- (il cloruro di sodio dissocia in uno ione sodio e uno ione cloruro)
K2O --> 2 K+ + O-2 (l'ossido di potassio dissocia in due ioni potassio e uno ione ossido)
Poiche' gli elettroni interni sono attratti dal nucleo molto piu' fortemente dell'unico elettrone esterno, questi non vengono mai ceduti e questi elementi non formano mai ioni con carica superiore a +1.
Nel loro stato elementare gli elementi del primo gruppo sono solidi metallici, buoni conduttori di corrente e di calore. Pero', a causa della loro reattivita', devono essere protetti dall'ossigeno che reagisce formando gli ossidi corrispondenti. In acqua l'ossido dissocia come visto sopra e da reazione alcalina (su questo punto si veda la lezione sugli equilibri in soluzione): per questo gli elementi del primo gruppo, ad esclusione dell'idrogeno, sono chiamati metalli alcalini.
Il secondo gruppo: metalli alcalino-terrosi
Gli elementi del secondo gruppo della tavola periodica presentano la configurazione elettronica esterna Ns2. Ad esempio Be ha la configurazione elettronica esterna 2s2, Mg ha 3s2, Ca ha 4s2, etc. Questi elementi hanno valori di elettronegativita' molto bassi (tra 1,6 e 0,9) e formano legami ionici, cedendo i loro due elettroni piu' esterni all'atomo (o agli atomi) col quale si legano. Composti tipici sono ad esempio: gli ossidi con formula BeO, MgO, CaO, etc. e gli alogenuri con formula MgBr2, CaCl2 etc. Poiche' il legame e' ionico, questi composti disciolti in acqua si dissociano negli ioni corrispondenti:
CaCl2 --> Ca+2 + 2 Cl- (il cloruro di calcio dissocia in uno ione calcio e due ioni cloruro)
CaO --> Ca+2 + O-2 (l'ossido di calcio dissocia in uno ione calcio e uno ione ossido) Poiche' gli elettroni interni sono attratti dal nucleo molto piu' fortemente dei due elettroni esterni, questi non vengono mai ceduti e questi elementi non formano mai ioni con carica superiore a +2; lo ione con carica +1 e' instabile e si ossida rapidamente a +2 (si veda la lezione sulle ossido-riduzioni).
Nel loro stato elementare gli elementi del secondo gruppo sono solidi metallici, buoni conduttori di corrente e di calore. In presenza di ossigeno formano facilmente gli ossidi corrispondenti, che in acqua dissociano come visto sopra e danno reazione alcalina (su questo punto si veda la lezione sugli equilibri in soluzione). Poiche' in genere gli ossidi, gli idrossidi e i sali di questi elementi non sono molto solubili, messi in acqua lasciano un corpo di fondo (su questo punto si veda la lezione sulla solubilita'), gli elementi del secondo gruppo sono chiamati metalli alcalino-terrosi.
Gli elementi del terzo gruppo
Gli elementi del terzo gruppo della tavola periodica presentano la configurazione elettronica esterna Ns2p1. Ad esempio B ha la configurazione elettronica esterna 2s2p1, Al ha 3s2p1, etc. Questi elementi hanno valori di elettronegativita' piuttosto bassi (tra 2 e 1,8) e con gli elementi piu' elettronegativi formano legami ionici, cedendo i loro tre elettroni piu' esterni all'atomo (o agli atomi) col quale si legano. Composti tipici sono ad esempio: gli ossidi con formula Al2O3, e gli alogenuri con formula AlCl3 etc. Poiche' il legame e' ionico, questi composti disciolti in acqua si dissociano negli ioni corrispondenti:
AlCl3 --> Al+3 + 3 Cl- (il cloruro di alluminio dissocia in uno ione alluminio e tre ioni cloruro)
Al2O3 --> 2 Al+3 + 3 O-2 (l'ossido di alluminio dissocia in due ioni alluminio e tre ioni ossido)
Poiche' gli elettroni interni sono attratti dal nucleo molto piu' fortemente dei tre elettroni esterni, questi non vengono mai ceduti e questi elementi non formano mai ioni con carica superiore a +3; gli ioni con carica +1 e +2 sono instabili e si ossidano rapidamente a +3 (si veda la lezione sulle ossido-riduzioni).
Nel loro stato elementare gli elementi del secondo gruppo sono solidi metallici, buoni conduttori di corrente e di calore. Sono discretamente resistenti all'ossidazione in presenza di ossigeno formano facilmente gli ossidi corrispondenti). in genere gli ossidi, gli idrossidi e i sali di questi elementi non sono molto solubili in acqua.
Il boro, piu' elettronegativo, differisce dagli elementi piu' pesanti dello stesso gruppo, in quanto forma legami covalenti polari anziche' ionici, anche con l'ossigeno. Ad esempio se si confrontano i due composti di formula simile B(OH)3 e Al(OH)3, si osserva che disciolti in acqua hanno comportamento molto diverso:
B(OH)3 + H2O <==> H2BO3- + H3O+
Al(OH)3 --> Al+3 + 3 OH-
Si osserva che B(OH)3 si comporta come un acido debole perche' il legame O-H e' piu' polarizzato del legame B-O; ed infatti la formula corretta del composto va scritta come H3BO3. Per contro Al(OH)3 si comporta come un idrossido perche' il legame Al-O e' piu' polarizzato del legame O-H. I due composti differiscono anche nei nomi: acido borico e idrossido di alluminio.
Gli elementi del quarto gruppo
Gli elementi del quarto gruppo della tavola periodica presentano la configurazione elettronica esterna Ns2p2. Ad esempio C ha la configurazione elettronica esterna 2s2p2, Si ha 3s2p2, etc. Questi elementi hanno valori di elettronegativita' intermedia tra quelli degli elementi piu' elettronegativi e quelli degli elementi meno elettronegativi del loro periodo: ad esempio il secondo periodo inizia con Li che ha elettronegativita' uguale a 1 e finisce con F che ha 4; C e' esattamente intermedio con 2,5. Come conseguenza gli elementi del quarto gruppo formano legami covalenti, piu' o meno polari. I loro ossidi (in precedenza chiamati anidridi) hanno formule del tipo CO2, SiO2, etc. e in acqua danno reazione acida, anziche' basica, come accade per gli ossidi degli elementi dei primi tre gruppi. Molti dei loro composti sono insolubili e formano minerali di vari tipi (silicati, carbonati). La marcata diminuzione dell'elettronegativita' all'aumentare del periodo fa si che i piu' pesanti tra gli elementi del quarto gruppo abbiano carattere metallico (ad es. Sn, Pb).
Gli elementi del quinto gruppo
Gli elementi del quinto gruppo della tavola periodica presentano la configurazione elettronica esterna Ns2p3. Ad esempio N ha la configurazione elettronica esterna 2s2p3, P ha 3s2p3, etc. Questi elementi hanno elevati valori di elettronegativita' e formano legami covalenti polari. La presenza di un doppietto elettronico spaiato nel loro livello esterno gli consente inoltre di formare legami dativi.
Gli ossidi di questi elementi sono spesso atipici: ad esempio sia l'ossido di azoto (NO) che l'anidride nitroso-nitrica (NO2) hanno un numero dispari di elettroni e sono quindi radicali (composti con un elettrone spaiato). I composti binari di questi elementi con l'idrogeno sono basi deboli: ad es. NH3 (ammoniaca); PH3 (fosfina). I composti con idrogeno e ossigeno sono ossiacidi: ad es. HNO2 (acido nitroso); HNO3 (acido nitrico); H3PO4 (acido fosforico).
Gli elementi del sesto gruppo
Gli elementi del sesto gruppo della tavola periodica presentano la configurazione elettronica esterna Ns2p4. Ad esempio O ha la configurazione elettronica esterna 2s2p4, S ha 3s2p4, etc. Questi elementi hanno elevati valori di elettronegativita' e formano legami covalenti polari. La presenza di due doppietti elettronici spaiati nel loro livello esterno gli consente inoltre di formare legami dativi.
Lo ione monoatomico stabile caratteristico di questi elementi si forma per cattura di due elettroni, e presenta doppia carica negativa e configurazione elettronica esterna Ns2p6. Ad es. O-2 (ione ossido); S-2 (ione solfuro).
I composti binari di questi elementi con l'idrogeno sono tendenzialmente acidi deboli: ad es. H2S (acido solfidrico); quelli con l'ossigeno sono anidridi acide (ad es. SO2: anidride solforosa; SO3: anidride solforica) i composti con idrogeno e ossigeno sono ossiacidi: ad es. H2SO4 (acido solforico).
Gli elementi del settimo gruppo
Gli elementi del settimo gruppo della tavola periodica presentano la configurazione elettronica esterna Ns2p5. Ad esempio F ha la configurazione elettronica esterna 2s2p5, Cl ha 3s2p5, etc. Questi elementi hanno elevati valori di elettronegativita' e formano legami covalenti polari o ionici. La presenza di tre doppietti elettronici spaiati nel loro livello esterno gli consente inoltre di formare legami dativi.
Lo ione monoatomico stabile caratteristico di questi elementi si forma per cattura di un elettrone, e presenta carica negativa e configurazione elettronica esterna Ns2p6. Ad es. F- (ione fluoruro); Cl- (ione cloruro).
I composti binari di questi elementi con l'idrogeno sono acidi deboli o forti: ad es. HF (acido fluoridrico); HCl (acido cloridrico); i composti con idrogeno e ossigeno sono ossiacidi: ad es. HClO4 (acido perclorico); HClO3 (acido clorico). In natura si trovano spesso in forma di sali quali NaCl, KI, etc.; di qui il nome di alogeni (generatori di sali).
I metalli di transizione
A partire dal quarto periodo compaiono nella tavola periodica i metalli di transizione, in numero di dieci per ogni periodo. I metalli di transizione presentano il parziale riempimento degli orbitali d del livello inferiore, ed hanno configurazione elettronica esterna Ns2(N-1)d1-10. Ad es.: ferro, Fe ; rame, Cu ; zinco, Zn .
I metalli di transizione formano ioni mono-, bi- o tripositivi, ma in genere non raggiungono la configurazione elettronica esterna del gas nobile che li precede: ad es.lo ione ferroso, Fe+2, ha configurazione elettronica esterna ; lo ione ferrico, Fe+3, ha . Gli ossidi hanno la formula necessaria per neutralizzare le cariche del metallo con quelle dello ione ossido (O-2): ad es. l'ossido ferroso ha formula FeO ; l'ossido ferrico ha Fe2O3.
Oltre ai composti ionici, i metalli di transizione possono formare i complessi di coordinazione, accettando doppietti elettronici in legami dativi: ad es. lo ione ferricianuro Fe(CN)6. Si noti che il doppietto non e' fornito dal metallo ma dal suo ligando: il metallo mette a disposizione un orbitale vuoto. Un esempio biologicamente importante e' dato dal legame di coordinazione tra ferro e ossigeno nell'emoglobina. La geometria e il numero di ligandi dei complessi di coordinazione dipendono dallo stato di ibridazione e dal grado di riempimento degli orbitali d. Casi frequenti sono la geometria tetraedrica dei complessi tetracoordinati, piramidale dei pentacoordinati e ottaedrica (a doppia piramide) degli esacoordinati (figura). Anche se il metallo e' in genere uno ione positivo, e il ligando e' spesso uno ione negativo, il legame tra i due non e' ionico ma covalente dativo, e il complesso di coordinazione non e' un sale e non dissocia in acqua. Infatti, ai fini della formazione del complesso la natura ionica del ligando non e' necessaria, solo frequente, ed esistono ligandi non carichi (ad es. l'ossigeno nel caso dell'emoglobina).
1) ACIDO: un composto che contiene un atomo di idrogeno legato ad un atomo elettronegativo con legame ionico o covalente polare. Se questo composto viene disciolto in acqua la componente dell'energia di legame dovuta all'attrazione elettrostatica viene a mancare (per via della elevata costante dielettrica dell'acqua), e il legame si rompe liberando uno ione idrogeno e un anione. Ad es.: HCl --> H+ + Cl-.
Si chiama ossiacido un acido nel quale l'idrogeno dissociabile e' legato ad un atomo di ossigeno e idracido un acido nel quale l'idrogeno dissociabile e' legato ad un atomo diverso dall'ossigeno. Il nome degli ossiacidi finisce in genere in -ico; quello degli idracidi in -idrico. Ad es. HCl e' l'acido cloridrico (un idracido), H2CO2 l'acido formico (o acido metanoico, un ossiacido). Molto frequentemente lo stesso atomo non metallico puo' dare piu' di un solo ossiacido formando composti con formula HnXOn, che differiscono tra loro per il numero di atomi di ossigeno. In questi casi il nome dell'ossiacido che ha il minor contenuto di ossigeno ha desinenza -oso, l'altro ha desinenza -ico. Un esempio e' dato dagli ossiacidi dell'azoto nitroso e nitrico (si vedano le formule riportate nelle figure 6 e 7).
2) SALE. Un sale e' un composto nel quale due o piu' ioni (diversi dalle forme ioniche dell'idrogeno e dell'ossigeno) sono tenuti insieme da legami ionici. Una caratteristica dei sali e' la dissociazione completa in acqua; ad esempio:
NaI --> Na+ + I-
NH4Cl --> NH4+ + Cl-
Un sale puo' essere ottenuto da un acido sostituendo lo ione idrogeno con un altro ione positivo; oppure puo' essere prodotto facendo reagire un acido con una base (ad es. un ossido o un idrossido). Ad esempio la reazione dell'acido nitroso con l'idrossido di sodio da come prodotto il sale nitrito di sodio:
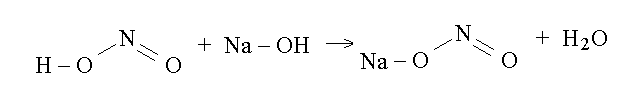
Poiche' si puo' considerare un sale come derivato da un acido, anche il nome del sale viene preso da quello dell'acido con le seguenti regole: il sale di un acido -idrico ha desinenza -uro (ad es. i sali derivati dall'acido cloridrico sono i cloruri); quello di un acido -oso ha desinenza -ito (acido nitroso e nitrito); quello di un acido -ico ha desinenza -ato (acido nitrico e nitrato). Il nome del sale e' lo stesso del nome dello ione negativo che deriva dalla sua dissociazione (ad es. il sale cloruro di sodio disciolto in acqua dissocia in ione cloruro, negativo, e ione sodio, positivo; il nitrato di sodio in ione nitrato, negativo, e ione sodio, positivo).
3) OSSIDI E PEROSSIDI. Nella nomenclatura chimica tradizionale gli ossidi sono molecole che contengono uno ione ossido (O-2), in genere legato con legame ionico a ioni positivi. I perossidi sono invece molecole che contengono uno ione perossido (O-O-2). Nella nomenclatura attuale sono chiamati ossidi tutti i composti binari dell'ossigeno quando questo ha numero di ossidazione -2 e perossidi tutti quelli nei quali l'ossigeno ha numero di ossidazione -1 (sulla definizione di numero di ossidazione si veda piu' avanti). Ad es.: Na2O (ossido di sodio); H2O2 (perossido di idrogeno; acqua ossigenata); H2O (acqua; ossido di idrogeno).
4) IDROSSIDI: sono i composti che contengono lo ione idrossido (OH-) legato con legame ionico ad uno ione positivo (si veda sopra, composti ternari dell'ossigeno).
ACIDO CARBONICO, BICARBONATO, CARBONATO. L'acido carbonico e' il prodotto dell'idratazione dell'anidride carbonica:
CO2 + H2O <==> H2CO3
L'acido e' instabile in acqua e tende a ritrasformarsi in anidride carbonica oppure a dissociare uno ione idrogeno per formare lo ione bicarbonato (HCO3-); lo ione bicarbonato a sua volta puo' dissociare un altro ione idrogeno e trasformarsi in ione carbonato (CO3-2). L'anidride carbonica e lo ione bicarbonato sono importanti per la medicina in quanto presenti in elevate concentrazioni nel sangue dell'uomo.La sostituzione di uno ione idrogeno dell'acido carbonico con un altro ione positivo produce il sale bicarbonato (ad es. NaHCO3, bicarbonato di sodio); la sostituzione di entrambi gli ioni idrogeno con altri ioni positivo produce il sale carbonato (ad es. Na2CO3, carbonato di sodio; CaCO3, carbonato di calcio; si noti che il calcio e' un catione bipositivo mentre il sodio e' monopositivo). Alcune formule di struttura:
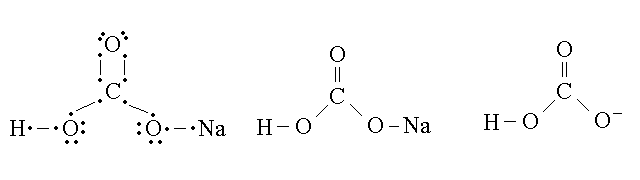
Figura 9: Formule del bicarbonato di sodio e dello ione bicarbonato.
FOSFATO. Si chiamano fosfati gli ioni (e i sali) derivati dall'acido fosforico (H3PO4). Il fosforo appartiene al terzo periodo e al quinto gruppo ed ha quindi 5 elettroni nel livello esterno. Nell'acido fosforico il fosforo usa i suoi tre elettroni spaiati per formare tre legami covalenti polari con tre gruppi OH; usa inoltre la sua coppia di elettroni per formare un legame dativo (orbitale σ) con il quarto atomo di ossigeno. La descrizione della molecola pero' non si ferma qui perche' il fosforo riceve in uno dei suoi orbitali 3d, energeticamente possibili ma non abitati da elettroni, un legame dativo dal quarto atomo di ossigeno (orbitale π), formando quindi a tutti gli effetti un doppio legame P=O.
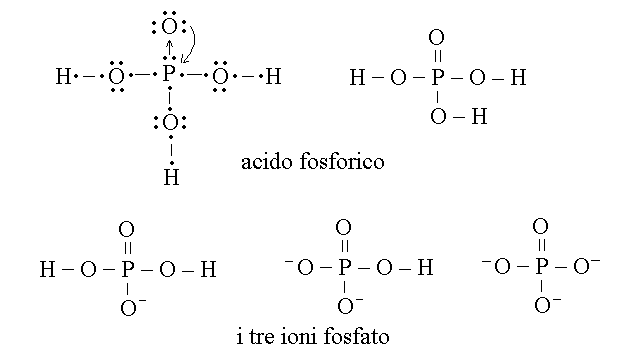
Figura 10: Formule dell'acido fosforico e dei tre ioni fosfato.
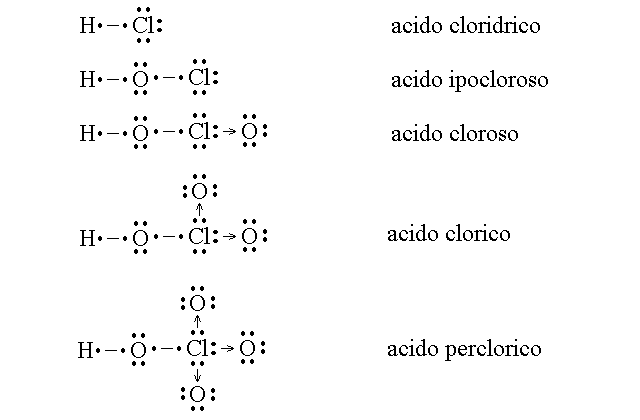
GLI ACIDI DEL CLORO. Il cloro e' interessante perche' da la piu' numerosa serie possibile di acidi: un idracido e quattro ossiacidi, distinti per il numero di legami dativi formati dall'atomo di cloro con atomi di ossigeno:
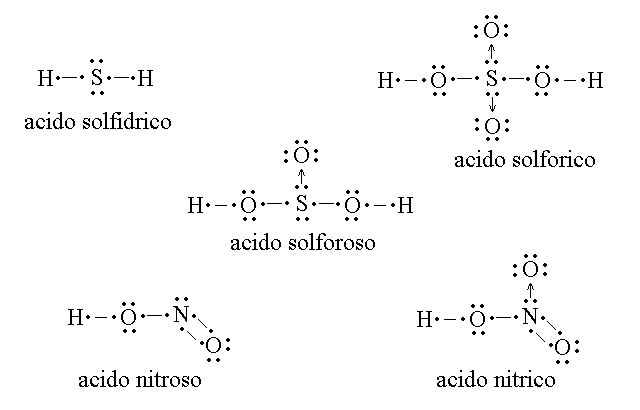
GLI ACIDI DELL'AZOTO E DELLO ZOLFO. L'azoto da due ossiacidi importanti: nitroso (HNO2) e nitrico (HNO3); i rispettivi sali si chiamano nitriti e nitrati. Lo zolfo da un idracido, l'acido solfidrico (H2S), e due ossiacidi, gli acidi solforoso (H2SO3) e solforico (H2SO4). I sali degli acidi dello zolfo si chiamano rispettivamente solfuri, solfiti e solfati.
CIANURI E ACIDO CIANIDRICO: sono veleni tristemente famosi (usati tra l'altro dai nazisti) che bloccano la respirazione cellulare perche' inibiscono l'enzima citocromo ossidasi. L'acido cianidrico e' uno dei pochissimi composti nei quali si dissocia un atomo di idrogeno legato ad uno di carbonio.
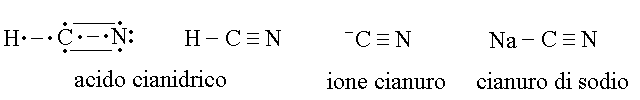
ACQUA. L'acqua e' il solvente dei liquidi biologici ed e' quindi molto importante. Il nostro corpo e' costituito da acqua per circa il 70% in peso. La formula e' H2O e l'atomo di ossigeno presenta ibridazione sp3 e geometria tetraedrica distorta, con un angolo di legame di 105 gradi (leggermente inferiore agli attesi 109,5). A causa della sua forma e della diversa elettronegativita' dell'ossigeno (3,5) e dell'idrogeno (2,1), la molecola dell'acqua e' un dipolo stabile che presenta il polo negativo sull'ossigeno e quello positivo tra i due atomi di idrogeno. Per questo motivo le molecole di acqua interagiscono tra loro in modo alquanto intenso; di qui l'elevato punto di ebollizione ed altre proprieta' della sostanza.

(testo riveduto ottobre 2012)
Torna a: didattica; Medicine non Scientifiche; Biblioteca Digitale.