PRIMA FACOLTA' DI MEDICINA E CHIRURGIA - CLM "B"
SAPIENZA UNIVERSITA' DI ROMA
Si chiamano equilibri ionici in soluzione quelli che coinvolgono l'autoprotolisi (rilascio di ione idrogeno) del solvente. L'acqua e' un solvente capace di autoprotolisi e quindi da luogo ad equilibri ionici, di scambio di ione idrogeno. Gli equilibri ionici in soluzione acquosa sono molto importanti in medicina (il nostro corpo e' costituito peril 70% in peso da acqua), ma sono resi complicati dalla coesistenza di riferimenti a teorie diverse, che comportano una terminologia spesso imprecisa e confusa.
Esistono tre teorie importanti, ciascuna delle quali e' una evoluzione della precedente, dovute a:
1) Arrhenius
2) Bronsted e Lowry
3) Lewis
Per gli scopi del nostro corso e' preferibile usare la seconda, ma non si puo' fare a meno di conoscere i rudimenti della prima perche' i suoi termini fondamentali sono ancora spesso usati per descrivere la fisiopatologia respiratoria.
Svante Arrhenius (attivo a Stoccolma alla fine del 1800) propose la prima teoria coerente degli acidi e delle basi:
1) un acido e' una sostanza che in acqua puo dissociarsi, liberando ione idrogeno; ad es. HCl --> H+ + Cl-
2) una base (o alcali) e' una sostanza che in acqua puo dissociarsi, liberando ione idrossido (chiamato anche ione ossidrile); ad es. NaOH --> Na+ + OH-
3) una soluzione e' acida se contiene un eccesso di ione idrogeno, basica se contiene un eccesso di ione idrossido.
4) un acido (o una base) si definisce forte se si dissocia irreverisbilmente (e quindi completamente), debole se si dissocia reversibilmente (e quindi parzialmente), stabilendo un equilibrio tra le specie dissociata e indissociata. Si considerino i seguenti esempi:
acido forte: HCl --> H+ + Cl-
acido debole: HNO2 <==> H+ + NO2-
base forte: NaOH --> Na+ + OH-
base debole: NH3 + H2O <==> NH4OH <==> NH4+ + OH-
La teoria di Arrhenius individua alcune caratteristiche importanti delle soluzioni acide e basiche, ma si rivelo' ben presto insufficiente; basti dire che per spiegare la basicita' delle soluzioni di ammoniaca doveva ipotizzare la formazione dell'idrossido di ammonio, un composto presente soltanto in minima quantita' nella soluzione (si veda l'esempio riportato sopra).
Intorno al 1925, Bronsted e Lowry proposero una nuova teoria, che teneva conto di alcune scoperte rilevanti e che si ispirava alla teoria delle ossido-riduzioni. Il singolo punto piu' rilevante e' il seguente: lo ione idrogeno e' molto reattivo (infatti e' un nucleo nudo, un protone isolato) e non si trova come tale in soluzione, ma sempre combinato con altre sostanze; gli equilibrio ionici sono quindi scambi di ione idrogeno tra un donatore (l'acido) e un accettore (la base).
L'acqua, come anche altri solventi, da luogo ad una reazione acido-base con se stessa, chiamata autoprotolisi;
In questa reazione una molecola d'acqua si comporta come un acido e cede uno ione idrogeno ad un'altra molecola d'acqua, che lo acquista e si comporta quindi come una base. Come vuole la teoria di Bronsted e Lowry, lo ione idrogeno non rimane isolato in soluzione, ma e' combinato con una molecola di solvente per formare lo ione idronio (H3O+).
L'autoprotolisi dell'acqua avviene in misura molto ridotta: nell'acqua distillata a 25 C sono presenti soltanto 10-7 moli/litro di ione idronio e altrettante di ione idrossido. La costante di equilibrio risulta:
Poiche' la reazione avviene in misura cosi' ridotta che il consumo di acqua e' irrilevante (un litro di acqua ne contiene all'incirca 55,5 moli e la reazione consuma soltanto due decimi di milionesimo di mole), si puo' considerare costante la concentrazione dell'acqua e portarla nella costante di equilibrio; si ottiene quindi una nuova costante chiamata prodotto ionico dell'acqua (KW):
Osserviamo che in questo capitolo faremo largo uso di questa semplificazione e denoteremo con KX la costante di equilibrio di una qualunque reazione X, moltiplicata per la concentrazione dell'acqua (o una sua potenza).
L'acido di Bronsted cede uno ione idrogeno ad una base; se il solvente e' capace di autoprotolisi e puo' quindi comportarsi sia come acido che come base, lo scambio avviene tra l'acido e il solvente. Ad esempio:
Mentre nella teoria di Arrhenius l'acido cloridrico e' forte perche' dissocia completamente, nella teoria di Bronsted il paio formato dall'acido cloridrico e dall'acqua e' forte, perche' l'acido trasferisce irreversibilmente il suo ione idrogeno al solvente. La distinzione puo' sembrare di poco conto, ma rende ragione di un dato sperimentale importante: l'acido cloridrico e' forte in acqua ma e' invece debole in altri solventi che hanno minore tendenza all'autoprotolisi (ad es. l'etanolo).
Un acido debole, nella teoria di Bronsted va ad equilibrio con il solvente e lo scambio di ione idrogeno e' reversibile; ad esempio:
Assumendo come costante la concentrazione dell'acqua si puo' scrivere:
La base di Bronsted accetta uno ione idrogeno da un acido; se il solvente e' capace di autoprotolisi lo accetta dal solvente. Ad esempio:
La base debole scambia reversibilmente lo ione idrogeno con il solvente e quindi stabilisce una condizione di equilibrio:
Come al solito e' lecito considerare costante la concentrazione dell'acqua per ottenere:
COPPIE ACIDO-BASE CONIUGATE. La prima conseguenza della teoria di Bronsted e Lowry e' che non si puo' considerare la dissociazione dell'acido o della base "da soli": un acido non dissocia uno ione idrogeno ma lo trasferisce ad una base e viceversa. La seconda conseguenza della teoria di Bronsted e Lowry e' la seguente: dopo che lo scambio di ione idrogeno e' avvenuto, quello che prima era l'acido si trasforma in una specie chimica privata dello ione idrogeno ma potenzialmente capace di riprenderlo (e cioe' in una base, chiamata la base coniugata dell'acido). Allo stesso modo dopo lo scambio di ione idrogeno quella che prima era la base ha acquistato uno ione idrogeno che potrebbe cedere e quindi si e' trasformata in un acido (chiamato l'acido coniugato della base). La teoria prevede quindi che ogni sostanza capace di questo tipo di reazioni esista in due forme, una contenente lo ione idrogeno e l'altra priva dello ione idrogeno; queste due forme della stessa sostanza costituiscono la coppia coniugata acido-base. La coppia coniugata di Bronsted e' dichiaramente ispirata alla coppia redox (si veda il capitolo sulle ossido-riduzioni). Ovviamente, i due termini della stessa coppia coniugata non compaiono insieme nella reazione chimica: uno dei due appare tra i reagenti, l'altro tra i prodotti, ed e' corretto dire che ogni equilibrio ionico deve coinvolgere almeno due coppie coniugate:
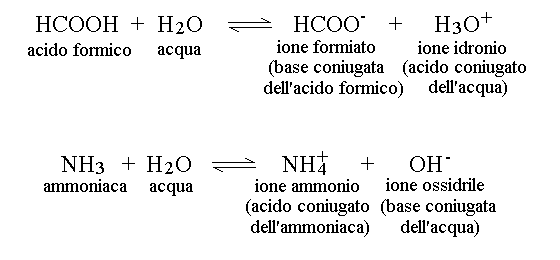
Figura 1: Coppie acido-base coniugate
E' molto importante sottolineare che la base coniugata dell'acido debole e' una base debole: infatti per debole si intende che la sua reazione e' reversibile ed e' ovvio che deve esserlo se l'acido di partenza e' debole: infatti l'acido debole va ad equilibrio con la sua base coniugata e non potrebbe farlo se la sua baseconiugata non andasse ad equilibrio con lui. Ovvero: l'acido e' debole perche' la reazione di formazione della base coniugata e' reversibile e questo implica che che anche la reazione inversa sia reversibile. Vedremo piu' avanti che la costante di basicita' della base coniugata dell'acido debole e' determinabile e corrisponde alla cosiddetta costante di idrolisi. Per contro se la base coniugata dell'acido debole fosse forte la sua reazione sarebbe irreversibile e non sarebbe possibile determinare una costante di equilibrio. Esattamente la stessa argomentazione si applica all'acido coniugato (debole) della base debole.
La base coniugata dell'acido forte non ha invece un vero comportamento basico e pertanto e' base soltanto di nome ma non di fatto, mentre sulle basi forti di Bronsted e sui loro acidi coniugati bisgna fare un discorso a parte.
Acidi e basi coniugate del solvente. Tutti i solventi capaci di autoprotolisi sono necessariamente anfoteri, cioe' capaci di comportarsi sia come basi (accettando ioni idrogeno) sia come acidi (donando ioni idrogeno). Ad esempio nel caso dell'acqua abbiamo visto nella figura 1 che l'acido coniugato di H2O e' H3O+, mentre la base coniugata di H2O e' OH-.
BASI FORTI. Le basi forti di Bronsted sono tali in relazione all'acido con il quale si trovano a reagire: infatti nella teoria di Bronsted e' forte il paio acido-base che reagisce irreversibilmente (e debole quello che reagisce reversibilmente). Quando il solvente e' capace di autoprotolisi e quindi in presenza della base si comporta come un acido, le basi di Brosnted possono essere assegnate a due classi distinte:
1) composti che contengono e rilasciano (in modo quantitativo e irreversibile) la base coniugata del solvente. Ad esempio, se il solvente e' l'acqua appartengono a questo gruppo gli idrossidi dei metalli alcalini e alcalino terrosi: NaOH --> Na+ + OH-
L'idrossido di un metallo alcalino e' un tipico esempio di base forte di Arrhenius perche' rilascia ione ossidrile (vedi sopra). Nella teoria di Bronsted l'idrossido del metallo alcalino non e' una base forte, ma un composto capace di liberare la base forte OH-. Coerentemente l'acido coniugato di OH- non e' NaOH ma H2O. Lo ione metallico non ha un ruolo nella teoria di Bronsted ed e' chiamato uno "ione spettatore": infatti non puo' ne' cedere ione idrogeno ne' combinarsi con questo.
2) Composti effettivamente capaci di estrarre in modo quantitativo e irreversibile uno ione idrogeno dal solvente; se il solvente e' l'acqua una base di questo tipo e' lo ione ossido:
Na2O --> 2 Na+ + O-2
O-2 + H2O --> 2 OH-
Consegue a questo ragionamento che, se il solvente da autoprotolisi, non puo' esistere in soluzione un acido piu' forte dell'acido coniugato del solvente ne' una base piu' forte della base coniugata del solvente. Infatti, acidi piu' forti dell'acido coniugato del solvente e basi piu' forti della base coniugata del solvente possono esistere, ma non rimangono tali in soluzione. L'acido piu' forte dell'acido coniugato del solvente (ad es. HCl) si converte integralmente e irreversibilmente nell'acido coniugato del solvente (in acqua: H3O+) e nella sua base coniugata che pero' non ha comportamento basico (Cl-). Allo stesso modo la base piu' forte della base coniugata del solvente (ad es. lo ione ossido, O-2) si converte integralmente e irreversibilmente nella base coniugata del solvente (in acqua: OH-; vedi sopra).
Poiche' le concentrazioni dello ione idronio sono solitamente molto basse, si ricorre ad una notazione logaritmica (N.B. il logaritmo e' l'esponente, in genere non intero, al quale bisogna elevare una base predefinita per ottenere il numero dato; ad es. il logaritmo in base 10 di 100 e' 2 perche' 100 = 102). Si definisce pH il logaritmo in base 10 cambiato di segno della concentrazione molare dello ione idronio:
In analogia col pH si definiscono anche:
pOH = -log10 [OH-]
pKW = -log10 KW
pKa = -log10 Ka
pKb = -log10 Kb
Tenendo conto che nella notazione logaritmica i prodotti diventano somme, vale la relazione:
pKW = pH + pOH
pH DELL'ACQUA, DEGLI ACIDI E DELLE BASI. La concentrazione dello ione idronio in acqua e' determinata dalla reazione di autoprotolisi, la cui costante (prodotto ionico dell'acqua) e' KW = 10-14 M2. In assenza di soluti capaci di rilasciare o legare ione idrogeno, vale le relazione:
dove il simbolo √ indica la radice quadrata. Di conseguenza nell'acqua pura si ha:
pH = -log10 10-7 = 7
pOH = -log10 10-7 = 7
Una soluzione acquosa nella quale [H3O+] = [OH-] (e di conseguenza pH = pOH) e' definita neutra. Alla temperatura di 25 C il pH della soluzione neutra e' uguale a 7; pero', poiche' il Δ H dell'autoprotolisi dell'acqua e' piccolo, in genere si trascura la variazione della KW dovuta alla temperatura e si considera 7 il pH della neutralita' a qualunque temperatura.
Se una soluzione contiene un acido o una base, la relazione pH = pOH, che era valida per l'acqua pura, non vale piu' e si ha invece:
Nel caso degli acidi:
[H3O+] > [OH-]
[H3O+] > 10-7 M
pH < 7
pOH > 7
Nel caso delle basi:
[H3O+] < [OH-]
[OH-] > 10-7 M
pOH < 7
pH > 7
CALCOLO DEL pH DEGLI ACIDI E DELLE BASI.
L'acido forte in acqua si converte integralmente in ione idronio (piu' la sua base coniugata, che non ha effetto sul pH); pertanto, definita Ca la sua concentrazione analitica molare, valgono le relazioni:
[H3O+] = Ca
pH = -log ([H3O+]) = -log (Ca)
Per la base forte vale un ragionamento analogo, in quanto la base forte si converte integralmente in ione OH-; si ha quindi:
[OH-] = Cb
[H3O+] = KW / [OH-]
pOH = -log ([OH-]) = -log (Cb)
pH = 14 - pOH
Nota: la concentrazione analitica e' la concentrazione che si determinerebbe dividendo il peso della sostanza per il peso molecolare e poi per il volume, a prescindere dallo stato associato o dissociato della sostanza. La concentrazione vera dell'acido forte in acqua e' praticamente zero (l'acido e' interamente dissociato negli ioni che lo costituiscono), mentre la concentrazione analitica, che prescinde dalla dissociazione e' un numero facilmente calcolabile.
Nel caso dell'acido debole si ha un equilibrio del tipo:
HA <==> A- + H3O+
Ka = [A-] [H3O+] / [HA]
L'ultima equazione contiene tre incognite, ma e' possibile semplificarla ricorrendo ad alcune approssimazioni che permettono di calcolare con facilita' la concentrazione dello ione idronio. In primo luogo osserviamo che, essendo la soluzione elettricamente neutra, la somma delle concentrazioni delle cariche negative deve uguagliare quella delle cariche positive:
[A-] + [OH-] = [H3O+]
Poiche' la soluzione e' acida, la concentrazione di OH- deve essere di molto inferiore a quella delle altre e puo' essere trascurata; si ottiene la seguente uguaglianza approssimativa:
[A-] ~ [H3O+]
In secondo luogo osserviamo che:
Ca = [HA] + [A-]
Pero' se l'acido e' debole e non e' troppo diluito, la concentrazione della specie dissociata A- sara' trascurabile rispetto a quella della specie indissociata; questo ci porta all'approssimazione:
Ca ~ [HA]
Se ora sostituiamo le nostre approssimazioni nella Ka otteniamo:
Ka = [A-] [H3O+] / [HA] = [H3O+]2 / Ca
e da quest'ultima otteniamo infine: C2 = Ka Ca
Quindi il calcolo della concentrazione dello ione idronio nell'acido debole utilizza la seguente formula:
Naturalmente una volta ottenuto il valore di [H3O+] e' la definizione stessa del pH a dirci: pH = -log ([H3O+])
Il caso della base debole e' analogo a quello dell'acido debole:
NH3 + H2O <==> NH4+ + OH-
Kb = [NH4+] [OH-] / [NH3]
Si applicano le semplificazioni:
[NH4+] ~ [OH-]
[NH3] ~ Cb
e si ottiene:
Kb = [OH-]2 / Cb
[OH-] = √ (Kb Cb)
pOH = -log [OH-]
pH = 14 - pOH
Un sale e' un composto nel quale uno o piu' ioni positivi sono legati con legame ionico ad uno o piu' ioni negativi. Poiche' i legami ionici in acqua si rompono, i sali in soluzione acquosa sono interamente dissociati negli ioni che li costituiscono (fenomeno detto dissociazione elettrolitica).
Gli ioni derivanti dalla dissociazione dei sali possono essere ioni spettatori (cioe' ioni che non partecipano in alcun modo alle reazioni acido-base) oppure possono essere basi coniugate di acidi deboli o acidi coniugati di basi deboli. Negli ultimi due casi questi ioni interferiscono con l'autoprotolisi dell'acqua e danno soluzioni con pH diverso da 7. Ad esempio:
| NaCl --> Na+ + Cl- | ione spettatore + base coniugata di HCl |
| NaNO2 --> Na+ + NO2- | ione spettatore + base coniugata di HNO2 |
| NH4Cl --> NH4+ + Cl- | acido coniugato di NH3 + base coniugata di HCl |
Se uno degli ioni derivanti dalla dissociazione elettrolitica del sale e' l'acido coniugato di una base debole o la base coniugata di un acido debole, esso stabilisce l'equilibrio con la specie chimica da cui deriva e per farlo deve cedere o accettare ioni idrogeno dall'acqua. Questo fenomeno si chiama idrolisi salina ed ha per conseguenza che il pH della soluzione risulta (in genere) diverso da 7. A seconda del sale che si considera l'idrolisi puo' essere acida o basica.
caso 0) Il sale puo' essere considerato come il prodotto della neutralizzazione di un acdio forte con una base forte. Questo sale rilascia ioni incapaci di reagire con l'acqua e pertanto non da idorlisi; la sua soluzione ha pH =7.
caso 1) Idrolisi acida: si verifica quando uno degli ioni derivanti dalla dissociazione del sale e' l'acido coniugato di una base debole. Ad esempio in una soluzione acquosa di cloruro di ammonio si verificano le seguenti reazioni:
NH4Cl --> NH4+ + Cl-
NH4+ + H2O <==> NH3 + H3O+
La costante di equilibrio della seconda reazione (la prima e' irreversibile) si chiama costante di idrolisi (Ki), e come al solito include la concentrazione dell'acqua:
Ki = [NH3] [H3O+] / [NH4+]
Si osserva che l'acido coniugato della base debole si comporta a tutti gli effetti come un acido debole e quindi valgono le semplificazioni e la relazione gia' dimostrata per gli acidi deboli (con l'avvertenza che in questo caso al posto di Ca abbiamo Cs, la concentrazione del sale; e al posto della Ka abbiamo la Ki):
[H3O+] = √ (Ki Cs)
La costante di idrolisi ha una relazione con la costante di dissociazione della base debole da cui proviene l'acido coniugato; infatti tenendo presente che [H3O+] = KW / [OH-] , la Ki puo' essere riscritta come segue:
Ki = ([NH3] KW) / ([NH4+] [OH-]) = KW / Kb
Infatti il termine [NH3] / ([NH4+] [OH-]) e' il reciproco della Kb dell'ammoniaca, di cui lo ione ammonio e' l'acido coniugato.
E' appena il caso di notare che e' possibile determinare una Ki perche' l'acido coniugato della base debole e' un acido debole (come gia' dimostrato sopra) e stabilisce un equilibrio con la base debole da cui deriva; se fosse forte non ci sarebbero ne' equilibrio ne' Ki.
caso 2) Idrolisi basica: si verifica quando uno degli ioni derivanti dalla dissociazione del sale e' la base coniugata di un acido debole. Ad esempio in una soluzione acquosa di acetato di sodio si verificano le seguenti reazioni:
CH3-COONa --> CH3-COO-
CH3-COO- + H2O <==> CH3-COOH + OH-
La prima reazione e' irreversibile, la seconda va ad equilibrio secondo la legge di azione delle masse:
Ki = [CH3-COOH] [OH-] / [CH3-COO-] = KW / Ka
Applicando gli stessi ragionamenti gia' visti per il caso precedente, si ottiene:
[OH-] = √ (Ki Cs)
pOH = -log [OH-]
pH = 14 - pOH
Inoltre, ricordando che [OH-] = KW / [H3O+] , si puo' dimostrare che:
Ki = ([CH3-COOH] KW) / ([CH3-COO-] [H3O+])
Infatti il termine [CH3-COOH] / ([CH3-COO-] [H3O+]) e' il reciproco della Ka dell'acido acetico, di cui lo ione acetato e' la base coniugata.
caso 3) Sali i cui ioni sono la base coniugata di un acido debole e l'acido coniugato di una base debole, quali ad esempio l'acetato di ammonio:
CH3-COONH4 --> CH3-COO- + NH4+
In questo caso entrambi glio ioni danno luogo ad idrolisi ed il pH della soluzione e' determinato dal prevalere dell'una o dell'altra delle due reazioni. Questo caso e' un equilibrio multiplo complesso e non viene trattato in modo quantitativo nel nostro corso.
La soluzione di un acido debole e di un suo sale, o di una base debole e di un suo sale, costituisce un tampone.
Le soluzioni tampone minimizzano le variazioni del pH che si osservano a seguito dell'aggiunta alla soluzione di ulteriori acidi o basi.
La concentrazione dello ione idrogeno nelle soluzioni acquose diluite e' molto piccola e minime aggiunte di acidi o di basi la fanno variare in modo significativo (infatti le soluzioni di acidi o di basi concentrate, che hanno valori di pH <3 o >11 sono molto piu' resistenti alle variazioni del pH); per questo le coluzioni tampone sono cosi' importanti.
Il pH di tutti i liquidi biologici (sangue, liquido extra- ed intra-cellulare) e' mantenuto costante da sistemi tampone.
Un esempio di tampone e' quello costituito dall'acido formico e dal suo sale formiato di sodio, che in acqua vanno incontro alle seguenti dissociazioni:
HCOONa --> HCOO- + Na+
HCOOH + H2O <==> HCOO- + H3O+
La prima reazione (dissociazione elettrolitica del sale) e' irreversibile e completa; a tutti gli effetti pratici non va ad un vero equilibrio e non possiede quindi una costante. L'idrolisi dello ione formiato, in presenza del suo prodotto (l'acido formico del tampone) puo' essere trascurata. La seconda reazione e' la dissociazione reversibile ed incompleta dell'acido debole; questa raggiunge una condizione di equilibrio chimico e obbedisce alla legge d'azione delle masse:
Ka = [HCOO-] [H3O+] / [HCOOH]
Poiche' il sale e' completamente dissociato negli ioni costituenti, mentre l'acido lo e' solo in piccola parte, si possono indicare le concentrazioni analitiche dell'acido e del sale con Ca e Cs e proporre le seguenti approssimazioni:
[HCOO-] = Cs
[HCOOH] = Ca
Queste approssimazioni trascurano l'idrolisi del sale (che trasforma un po' della base coniugata in acido) e la dissociazione dell'acido (che trasforma un po' di acido nella sua base coniugata, cioe' nel sale). Possiamo quindi riscrivere la Ka come segue:
Ka = Cs [H3O+] / Ca
Da quest'ultima formula si ricava:
[H3O+] = Ka Ca / Cs
che, trasposta in forma logaritmica, ci da l'equazione di Henderson e Hasselbalch:
pH = pKa + log (Cs / Ca)
Come si vede il pH del tampone e' collegato al rapporto tra le concentrazioni del sale e dell'acido, che possono essere anche molto grandi; questo inibisce le variazioni del pH perche' per cambiare la concentrazione dello ione idronio bisogna anche cambiare in modo significativo Ca e/o Cs. Inoltre l'equazione di Henderson e hasselbalch ci mostra che il pH di un tampone costituito da acido debole e suo sale deve essere prossimo al pKa dell'acido utilizzato, perche' il termine correttivo e' piccolo (logaritmo di un rapporto non troppo lontano da 1). In pratica si considera che il pH di un tampone come questo sara' compreso entro una unita' sopra o sotto il pKa: pKa + 1 > pH > pKa - 1. Quando saranno descritte le titolazioni acido-base si trovera' una ragione piu' quantitativa per questa relazione.
Cosa accade se si aggiunge acido o base a un tampone? L'aggiunta di un acido estraneo al tampone (ad es. HCl) trasforma una piccola quantita' di sale in acido secondo la reazione irreversibile:
HCOONa + HCl --> HCOOH + NaCl
L'aggiunta di una piccola quantita' di una base estranea al tampone (ad es. NaOH) trasforma una piccola quantita' di acido in sale, secondo la reazione irreversibile:
HCOOH + NaOH --> HCOONa + H2O
In entrambi i casi si ha una piccola variazione delle concentrazioni dell'acido e del sale (mentre rimane costante la loro somma Ca + Cs), che ocmporta una piccola variazione del pH, di molto inferiore a quella che si osserverebbe se l'acido o la base fossero aggiunti all'acqua o ad una soluzione non tamponata.
Anche l'aggiunta di acidi o basi non estranei al tampone (nel nostro esempio sono non estranei HCOOH e HCOONa) comporta piccole variazioni del rapporto tra Ca e Cs; l'unica differenza rispetto al caso precedente e' che in questo caso non rimane costante la somma Ca + Cs.
Un esempio di tampone di base debole e suo sale e' dato dal sistema ammoniaca - cloruro di ammonio, che da le reazioni:
NH4Cl --> NH4+ + Cl-
NH3 + H2O <==> NH4+ + OH-
Anche in questo caso si considerano completa ed irreversibile la dissociazione del sale e trascurabile la sua idrolisi (perche' e' presente un prodotto di reazione, l'ammoniaca). Per la reazione di dissociazione della base debole si puo' scrivere la legge di azione delle masse:
Kb = [NH4+] [OH-] / [NH3]
Come nel caso precedente si possono indicare con Cb e Cs le concentrazioni analitiche della base e del sale e fare le seguenti approssimazioni:
[NH3] = Cb
[NH4+] = Cs
Questo ci consente di scrivere:
Kb = Cs [OH-] / Cb
[OH-] = Kb Cb / Cs
Questa equazione e' analoga a quella trovata per il tampone di acido debole, con la differenza che in questo caso viene calcolata la concentrazione dello ione ossidrile anziche' dello ione idronio, e puo' essere trasformata nella forma logaritmica di di Henderson e Hasselbalch:
pOH = pKb + log (Cs / Cb)
In analogia con il caso precedente, il pOH sara' prossimo al pKb: pKb + 1 > pOH > pKb - 1.
Anche le risposte del tampone basico all'aggiunta di acidi o basi estranee sono analoghe a quelle viste nel caso del tampone acido; infatti se si aggiunge un acido a questo tampone esso viene consumato nella reazione irreversibile:
NH3 + HCl --> NH4Cl
che trasforma un po' di base in sale. Se invece viene aggiunta al tampone una base si ha la reazione irreversibile:
NH4+ + NaOH --> NH3 H2O + Na+
CALCOLO DELLA VARIAZIONE DI pH DEL TAMPONE IN SEGUITO AD AGGIUNTA DI ACIDI O BASI.
Questo calcolo e' inmplicito nei principi gia' spiegati, ma viene qui reso esplicito con un esempio.
Si abbiano 500 mL di un tampone costituito da acido acetico 0,05 M e acetato di sodio 0,04 M e si aggiunga alla soluzione 1 mL di NaOH 2 M. Calcolare il pH precedente e successivo all'aggiunta di base, sapendo che la Ka dell'acido acetico e' 1,8x10-5 M.
Soluzione: prima dell'aggiunta di soda si aveva:
[H3O+] = Ka Ca / Cs = 1,8x10-5 x 0,05 / 0,04 = 2,25x10-5
pH = -log [H3O+] = 4,65
La soda aggiunta reagisce con l'acido trasformandolo in sale e cambia il pH perche' cambia il rapporto Ca / Cs. La reazione e':
CH3-COOH + NaOH --> CH3-COONa + H2O
Questa reazione consuma acido e produce sale; per determinare i nuovi valori di Ca e Cs dobbiamo calcolare il numero di moli di tutti i reagenti, utilizzando la formula n = C x V:
nCH3-COOH = 0,05 M x 0,5 L = 0,025 moli
nCH3-COONa = 0,04 M x 0,5 L = 0,02 moli
nNaOH = 2 M x 0,001 L = 0,002 moli
Poiche' la reazione e' irreversibile, essa procede fino all'esaurimento del reagente presente in minor quantita' (NaOH); vengono quindi consumate 0,002 moli di acido e prodotte 0,002 moli di sale, mentre la soda viene consumata interamente. Dopo l'aggiunta i nuovi valori di Ca, Cs e [H3O+] risultano quindi:
Ca = (0,025-0,002) / 0,501 L = 0,046 M
Cs = (0,02+0,002) / 0,501 L = 0,044 M
[H3O+] = Ka Ca / Cs = 1,8x10-5 x 0,046 / 0,044 = 1,88x10-5
pH = -log [H3O+] = 4,73
| FORMULE PER IL CALCOLO DEL pH | ||
| caso: | [H3O+] | [OH-] |
| acido forte (es. HCl) | Ca | (KW / [H3O+]) |
| base forte (es. NaOH) | (KW / [OH-]) | Ca |
| acido debole (es. CH3COOH) | √ (Ka Ca) | (KW / [H3O+]) |
| base debole (es. NH3) | (KW / [OH-]) | √ (Kb Cb) |
| sale che non da idrolisi (es. NaCl) | 10-7 M | 10-7 M |
| idrolisi acida (es. NH4Cl) | √ (Ki Cs) | (KW / [H3O+]) |
| idrolisi basica (es. CH3COONa) | KW / [OH-] | √ (Ki Cs) |
| doppia idrolisi (es. CH3COONH4) | non in programma | non in programma |
| tampone di acido debole | Ka Ca / Cs | (KW / [H3O+]) |
| tampone di base debole | KW / [OH-] | Kb Cb / Cs |
La titolazione e' la procedura nella quale si utilizza una reazione chimica per determinare la concentrazione (titolo) di una soluzione. In una titolazione-acido base, la reazione utilizzata e' la neutralizzazione di un acido con una base. Per effettuare una titolazione acido-base allaa soluzione a concentrazione ignota di acido (o di base) bisogna aggiungere goccia a goccia una soluzione a concentrazione nota di base (o di acido) e vengono misurati contemporaneamente il volume aggiunto (da quale si ricava il numero di moli del "titolante") ed il pH.
La strumentazione necessaria e' piuttosto semplice: la soluzione a concentrazione ignota e' contenuta in un recipiente chiamato beker e viene costantemente rimescolata utilizzando un agitatore magnetico; in essa e' immerso l'elettrodo di un pHmetro (lo strumento che misura il pH; e' basato sui principi delle pile ed e' spiegato nella lezione sulle ossido-riduzioni). Da una buretta (recipiente sottile e graduato, dotato di rubinetto) si fa cadere il titolante nella soluzione a titolo ignoto e ogni tanto si chiude il rubinetto e si annotano il volume aggiunto ed il pH della soluzione.
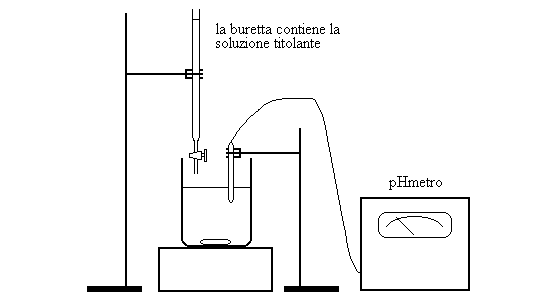
Negli esempi che seguono la reazione sara' descritta per come avviene in soluzioni a concentrazione nota: cioe' si assumera' di conoscere la concentrazione della soluzione da titolare (che nel vero esperimento sarebbe ignota) oltre a quella della soluzione titolante contenuta nella buretta (che nel vero esperimento sarebbe nota). Ovviamnete in queste condizioni la titolazione sarebbe inutile; pero' descrivere l'esperimento per la vera soluzione a titolo ignoto e' molto meno chiaro dal punto di vista didattico.
TITOLAZIONE DI ACIDO FORTE CON BASE FORTE. E' il caso piu' semplice. L'esperimento ha lo scopo di determinare la concentrazione della soluzione di un acido forte (contenuto nel beker) utilizzando una soluzione di base forte (il titolante, contenuto nella buretta) e sfrutta la reazione acido + base --> sale + acqua. Un esempio potrebbe essere il seguente:
HCl + NaOH --> NaCl + H2O
Quando la soluzione, inizialmente acida, diventa neutra, tutto l'acido e' stato consumato ed il numero di moli di base aggiunte e' uguale al numero di moli di acido inizialmente presente. Il pH della soluzione e' inizialmente determinato dall'acido non salificato; e' neutro quando il numero di moli di acido eguaglia il numero di moli della base perche' in soluzione e' presente soltanto il sale NaCl che e' di quelli che non danno idrolisi; e diventa infine basico quando la base e' in eccesso.
A scopo didattico possiamo calcolare come si comporterebbe un litro di una soluzione 0,01 M di HCl titolato con NaOH 1 M (data la grande differenza di concentrazione la variazione del volume totale della soluzione puo' essere trascurata se si vuole risparmiare tempo sui calcoli). In un vero esperimento la concentrazione di HCl dovrebbe essere ignota; ma in questo esempio noi fingiamo di conoscerla allo scopo di poter compilare la seguente tabella:
| ml di NaOH aggiunti (moli) | moli di NaCl | NaOH residuo | HCl residuo | pH |
| 0 (0) | 0 | 0 | 0,01 | 2 |
| 1 (0,001) | 0,001 | 0 | 0,009 | 2,05 |
| 2 (0,002) | 0,002 | 0 | 0,008 | 2,10 |
| 3 (0,003) | 0,003 | 0 | 0,007 | 2,15 |
| 4 (0,004) | 0,004 | 0 | 0,006 | 2,22 |
| 5 (0,005) | 0,005 | 0 | 0,005 | 2,30 |
| 6 (0,006) | 0,006 | 0 | 0,004 | 2,40 |
| 7 (0,007) | 0,007 | 0 | 0,003 | 2,52 |
| 8 (0,008) | 0,008 | 0 | 0,002 | 2,70 |
| 9 (0,009) | 0,009 | 0 | 0,001 | 3 |
| 10 (0,010) | 0,010 | 0 | 0,000 | 7 |
| 11 (0,011) | 0,010 | 0,001 | 0,000 | 11 |
| 12 (0,012) | 0,010 | 0,002 | 0,000 | 11,30 |
Che cosa e' successo nella titolazione? Prima di aggiungere soda (NaOH aggiunto = 0) avevamo in soluzione un acido forte, per il quale [H3O+] = Ca. Quando abbiamo cominciato ad aggiungere soda abbiamo in parte trasformato HCl in NaCl; la soda residua per i primi 10 ml era uguale a zero perche' tutto il reagente aggiunto veniva consumato, ed il pH della soluzione era determinato soltanto dall'acido forte in eccesso. Al decimo ml di soda il numero di moli di NaOH (calcolato con la formula n = CxV e consdierando che [NaOH] nella buretta e' 1 M) uguaglia il numero di moli di HCl (calcolato con la stessa formula ma con [HCl]=0,01 M e V=1 L) e pertanto in soluzione c'e' soltanto NaCl. Poiche' NaCl e' un sale che non causa idrolisi il pH della soluzione e' uguale a 7. Dall'undicesimo ml di soda in poi non c'e' piu' acido da salificare e si accumula base forte in soluzione; per calcolare il pH si deve usare la formula [OH-]=Cb per poi risalire al pOH ed infine al pH. Il risultato della titolazione puo' essere riportato in un grafico cartesiano che ha in ascissa il volume di NaOH aggiunto e in ordinata il pH:
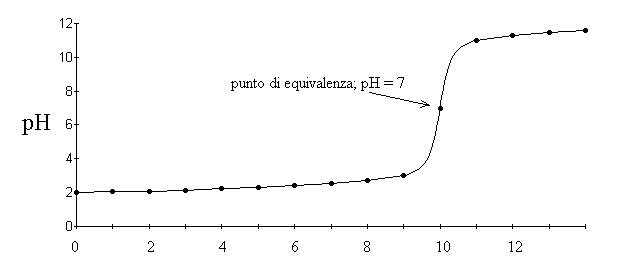
Anche se non avessimo su questa curva nessun punto a pH=7 (perche' non abbiamo aggiunto il preciso volume di soda necessario), sarebbe comunque facile tirare una curva che passi per i punti sperimentali e interpolare il volume di soda che sarebbe stato necessario per avere pH=7. Questo volume (misurato o stimato per interpolazione) e' quello al quale nacido=nbase; questa uguaglianza equivale a Cacido x Vacido = Cbase x Vbase e quindi consente di ricavare:
Cacido = Cbase x Vbase / Vacido
TITOLAZIONE DI ACIDO DEBOLE CON BASE FORTE.
In linea di principio questo esperimento e' analogo al precedente e consente di determinare la concentrazione dell'acido debole e la sua Ka; in pratica l'interpretazione e' piu' complessa per via degli equilibri che si instaurano in soluzione. Infatti la reazione chimica e' la stessa deò caso precedente, pero' quando nel corso della titolazione l'acido debole si trova in presenza del suo sale si forma una soluzione tampone. Inoltre quando si raggiunge il punto di equivalenza stechiometrica, la soluzione non e' neutra perche' il sale dell'acido debole da idrolisi basica. Di conseguenza la concentrazione dello ione idrogeno si determina con le seguenti formule:
| [H3O+] = √ (Ka Ca) | (prima di aggiungere la base) |
| [H3O+] = Ka Ca / Cs | (nel corso della titolazione) |
| [OH-] = √ (Ki Cs) , KW / [OH-] | (quando si raggiunge l'equivalenza) |
A scopo didattico possiamo calcolare come si comporterebbe un litro di una soluzione 0,01 M di CH3-COOH titolato con NaOH 1 M. Come nel caso della titolazione di HCl, anche in questo caso la concentrazione dell'acido acetico dovrebbe essere ignota; ma noi fingiamo di conoscerla allo scopo di poter compilare la seguente tabella:
| ml di NaOH aggiunti (moli) | moli CH3-COONa | NaOH residuo | CH3-COOH residuo | pH |
| 0 (0) | 0 | 0 | 0,01 | 3,37 |
| 1 (0,001) | 0,001 | 0 | 0,009 | 3,79 |
| 2 (0,002) | 0,002 | 0 | 0,008 | 4,14 |
| 3 (0,003) | 0,003 | 0 | 0,007 | 4,38 |
| 4 (0,004) | 0,004 | 0 | 0,006 | 4,57 |
| 5 (0,005) | 0,005 | 0 | 0,005 | 4,75 |
| 6 (0,006) | 0,006 | 0 | 0,004 | 4,92 |
| 7 (0,007) | 0,007 | 0 | 0,003 | 5,12 |
| 8 (0,008) | 0,008 | 0 | 0,002 | 5,35 |
| 9 (0,009) | 0,009 | 0 | 0,001 | 5,70 |
| 10 (0,010) | 0,010 | 0 | 0,000 | 8,52 |
| 11 (0,011) | 0,010 | 0,001 | 0,000 | 11 |
| 12 (0,012) | 0,010 | 0,002 | 0,000 | 11,30 |
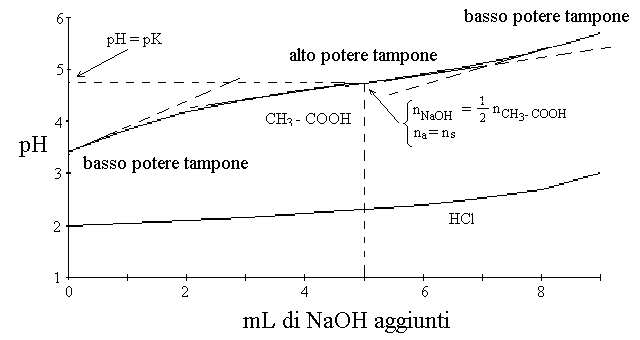
Il grafico della titolazione (con le annotazioni che descrivono i sistemi presenti in soluzione) e' il seguente:
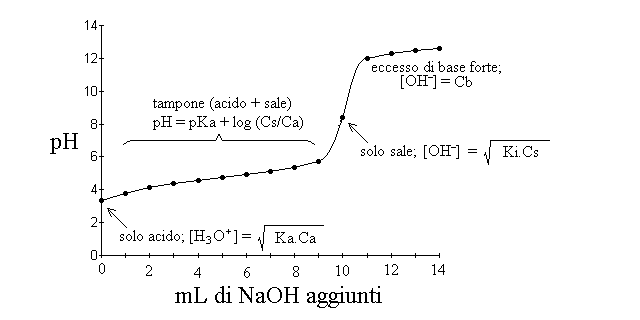
Se si espande la parte iniziale della titolazione dell'acido debole e la si confronta con la parte corrispondente della titolazione dell'acido forte si osserva che la prima presenta, a parita' di concentrazioni di acido, base e sale, un pH piu' alto e una forma caratteristica con un flesso centrale in corrispondenza del punto con ascissa nNAOH=1/2 nCH3-COOH e ordinata pH=pKa. Il reciproco della tangente della curva di titolazione dell'acido debole si chiama potere tampone, ed e' massimo laddove la curva ha la minima pendenza (ci vuole molta base per cambiare anche di poco il pH); questo avviene quando il pH e' prossimo al pKa (o, nel caso del tampone di base debole e suo sale, quando il pOH e' prossimo al pKb). In genere si assume che un tampone presenta un buon potere tampone quando il pH e' compreso tra pKa-1 e pKa+1.
Gli indicatori del pH sono acidi o basi deboli che assumono colore diverso nelle forme legata e non legata con lo ione idrogeno. Un esempio di indicatore del pH e' dato dal rosso fenolo:
L'indicatore del pH viene aggiunto alla soluzione in piccolissima quantita', tale da non alterare il pH della soluzione stessa. Non puo' essere usato per misurare il pH dell'acqua, perche' essendo un acido o una base lo cambierebbe; deve essere usato per misurare il pH di tamponi, acidi, basi, sali che danno idrolisi, etc., e cioe' di soluzioni in grado di mantenere costante il loro pH a dispetto dell'aggiunta di una piccola quantita' di indicatore.
Come si spiega il fatto che l'indicatore e' colorato e che il colore e' diverso per l'acido e per la sua base coniugata? Una sostanza e' colorata perche' puo' assorbire un quanto di luce e appare del colore complementare alla luce assorbita. Ad esempio se una sostanza appare rossa, questo vuol dire che quando la si illumina con luce bianca essa assorbe le radiazioni complementari al rosso (blu-verdi) e riflette o trasmette quelle rosse, che il nostro occhio percepisce. Per poter assorbire la luce, la sostanza deve avere due orbitali che presentino una piccola differenza di energia, in modo tale che un elettrone, assorbita l'energia di un quanto di luce, possa fare il salto quantico dall'orbitale di energia minore a quello di energia maggiore; le'nergia del quanto di luce deve quindi corrispondere alla differenza di energia tra due orbitali della molecola. E' inoltre necessario che l'orbitale di energia maggiore sia vuoto o contenga un solo elettrone, altrimenti il salto quantico non e' possibile (per il principio di esclusione di Pauli). Si chiama stato fondamentale della molecola quello nel quale gli elettroni occupano i livelli energetici piu' bassi possibili e stato eccitato quello nel quale un fotone ha promosso un elettrone in un livello energetico piu' elevato. Lo stato eccitato prima o poi decade nello stato fondamentale con emissione di luce o di calore. Poiche' la luce visibile al nostro occhio ha energie relativamente basse, le transizioni elettroniche che puo' eccitare sono piccole: spesso salti da un orbitale di legame di tipo π ad un anti-π. Questo fatto ha due conseguenze: (1) per il nostro occhio sono colorate in genere molecole organiche complesse, spesso aromatiche, con livelli elettronici π multipli e ravvicinati; (2) una sostanza puo' cambiare colore a causa di minime perdurbazioni della sua struttura che alterino anche di poco i livelli energetici degli orbitali di legame π (questo e' cio' che avviene agli indicatori quando acquistano o cedono uno ione idrogeno).
Per descrivere il funzionamento degli indicatori, possiamo considerare un generico indicatore del pH e chiamare HIn la forma legata con lo ione idrogeno e In- la forma che lo ha ceduto. In una soluzione acquosa si stabilisce l'equilibrio:
HIn + H2O <==> In- + H3O+
che ha la costante:
KIn = [In-] [H3O+] / [HIn]
La concentrazione dello ione idronio risulta:
[H3O+] = KIn [HIn] / [In-]
Questa equazione e' analoga a quella trovata per il tampone e puo' essere scritta in forma logaritmica (eq. di Henderson e Hasselbalch):
pH = pKHIn + log ([In-] / [HIn])
L'ultima equazione correla il colore della soluzione (espresso dal rapporto [In-] / [HIn]) con il pH e pertanto ne fornisce una indicazione visiva; rispetto alla scala del pH l'indicatore da questa informazione:
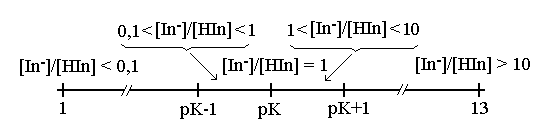
Si osserva in questa figura che l'uso di un indicatore divide la scala del pH in cinque regioni: se il pH della soluzione e' inferiore a (pKHIn - 1) la concentrazione di HIn e' largamente prevalente su quella di In- e la soluzione ci appare del colore di HIn. Se il pH e' compreso tra (pKHIn - 1) e pKHIn la concentrazione della forma dissociata (In-), pur se inferiore a quella della forma indissociata (HIn) e' significativa e il colore della soluzione ci appare come quello di HIn ma venato della tonalita' di In-. Quando pH = pKHIn la concentrazione delle due forme dell'indicatore e' la stessa e la soluzione ci appare di un colore esattamente intermedio tra quelli di HIn e In-; questo valore di pH e' quello che si determina con maggiore precisione e si chiama il punto di viraggio dell'indicatore. Se il pH e' compreso tra pKHIn e (pKHIn + 1), la concentrazione della forma dissociata (In-) prevale su quella della forma indissociata (HIn) e' significativa e il colore della soluzione ci appare come quello di In- ma venato della tonalita' di HIn. Infine se pH > (pKHIn + 1) la concentrazione di HIn e' troppo piccola per contribuire al colore della soluzione che e' risulta quindi uguale a quello della specie dissociata In-. Allo scopo di aumentare la precisione della determinazione e' possibile misurare le concentrazioni di HIn e In- con uno spettrofotometro anziche' ad occhio nudo. Si noti che la misura del pH effettuata con l'indicatore e' centrata sul pKHIn e non sulla neutralita' (pH=7); pertanto un indicatore ci dira' se la soluzione ha pH>pKHIn o pH
Un esempio di uso degli indicatori del pH e' dato dal seguente problema di stechiometria. Il blu di bromofenolo e' un acido debole con pKa = 4. La sostanza ha colore arancione, mentre la sua base coniugata ha colore blu. Posto nella soluzione di un acido della quale si vuole determinare il pH, l'indicatore assume colore intermedio e il rapporto tra le forme blu e arancione, misurato allo spettrofotometro, risulta uguale a 0,3. Qual e' il pH della soluzione?
Soluzione: sapendo che
[HIn] / [In-] = [arancione] / [blu] = 1 / 0,3
si applica l'equazione:
[H3O+] = KIn [HIn] / [In-]
e si ottiene:
[H3O+] = 10-4 x 1 / 0,33 = 3,3 x 10-4 M
Quindi il pH risulta: -log (3,3 x 10-4) = 3,48
I liquidi biologici contengono sistemi tampone che ne mantengono rigorosamente costante il pH. Il valore medio del pH del sangue nella popolazione degli individui sani, a riposo, e' di 7,4 con piccole variazioni conseguenti agli scambi coi tessuti e con l'aria del polmone, a seguito dei quali il sangue prelevato dalle vene sistemiche, con pH = 7,36, e' appena piu' acido di quello prelevato dalle arterie che ha pH = 7,44. I tamponi del sangue in ordine di importanza (cioe' di concentrazione e di potere tampone) sono:
| il sistema del bicarbonato / anidride carbonica | 25-28 mEq / L |
| il sistema dell'emoglobina | 3-5 mEq / L |
| il sistema del fosfato | circa 2 mEq / L |
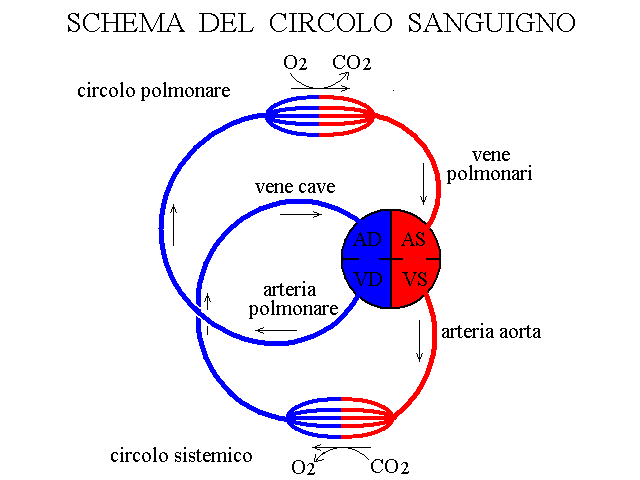
Per capire il funzionamento dei tamponi del sangue e' importante premettere qualche nozione elementare sulla fisiologia del sistema circolatorio dell'uomo. Il percorso di una cellula del sangue (ad es. un globulo rosso) a partire dall'atrio destro del cuore e' il seguente: atrio destro - ventricolo destro - arteria polmonare - capillari polmonari - vene polmonari - atrio sinistro - ventricolo sinistro - arteria aorta - arterie sistemiche . capillari sistemici - vene sistemiche - vene cave - atrio destro. In questo percorso circolare, che ogni globulo rosso percorre in media in un minuto (e quindi circa 1500 volte al giorno), gli scambi di sostanze avvengono soltanto a livello dei capillari pomonari (dove il sangue assorbe l'ossigeno e si libera dell'anidride carbnonica) e di quelli sistemici (dove il sangue cede l'ossigeno e si carica dell'anidride carbonica prodotta dai tessuti).
IL TAMPONE BICARBONATO - ANIDRIDE CARBONICA.
Gli equilibri chimici di questo sistema tampone sono i seguenti:
CO2 gas <==> CO2 aq
CO2 aq + H2O <==> H2CO3
H2CO3 + H2O <==> HCO3- + H3O+
HCO3- + H2O <==> CO3-2 + H3O+
Queste reazioni sono tutte reversibili e stabiliscono un equilibrio multiplo alquanto complicato. La prima reazione e' l'equilibrio di fase tra l'anidride carbonica gassosa e l'anidride carbonica disciolta nel sangue; avviene soltanto a livello dei capillari polmonari perche' in tutti gli altri distretti dell'organismo e' presente soltanto la forma disciolta (CO2 aq) e non c'e' gas. La costante di questo equilibrio e' il coefficiente di Henry per la CO2, pari a 0,031 mM / mmHg. La seconda reazione e' l'idratazione dell'anidride carbonica che la converte in acido carbonico. Avviene anche spontanemante ma nell'organismo e' catalizzata dall'enzima anidrasi carbonica. La terza reazione e' la prima dissociazione dell'acido carbonico; il suo prodotto e' lo ione bicarbonato; l'ultima reazione, infine, e' la seconda dissociazione dell'acido carbonico.
Tra queste reazioni le piu' importanti nel sangue sono la prima e la terza. La seconda e' fondamentale ma la concentrazione dell'acido carbonico indissociato e' trascurabile (circa 1/700 di quella dell'anidride carbonica), mentre la quarta non avviene che in minima misura al pH del sangue perche' la sua Ka e' piccolissima. Di conseguenza gli equilibri di questo sistema tampone possono essere semplificati e ridotti a sue sole reazioni, una delle quali limitata al polmone:
CO2 gas <==> CO2 aq
CO2 aq + 2 H2O <==> HCO3- + H3O+
L'ultima reazione, da sola, descrive il sistema tampone bicarbonato - anidride carbonica in tutti i distretti eccetto il polmone ed ha un pKa di 6,1 a 37 gradi (si noti che questo non e' il pKa dell'acido carbonico ma quello "composito" che deriva dall'aver riunito la reazione di idratazione con la prima dissociazione; il vero pKa della prima dissociazione dell'acido carbonico e' di circa 4,3).
I valori medi delle concentrazioni del bicarbonato e dell'anidride carbonica nel sangue umano sono: [HCO3-] = 26 mM e [CO2 aq] = 1,3 mM (corrispondente nel polmone ad una pressione parziale del gas pari a 1,3 / 0,031 = 42 mmHg). Si deve ricordare che l'anidride carbonica totale (cioe' la somma di tutte le forme che la sostanza puo' assumere in soluzione: CO2 aq, H2CO3, HCO3- e CO3-2) non segue la legge di Henry e pertanto non e' possibile calcolare la pressione parziale del gas con cui e' in equilibrio, in assenza di altre informazioni (ad es. del pH della soluzione). Per contro l'anidride carbonica in soluzione come tale (cioe' la sola CO2 aq) segue la legge di Henry.
In accordo con l'eq. di Henderson e Hasselbalch, il rapporto tra le concentrazioni del sale e dell'acido vale:
log (Cs / Ca) = pH - pKa = 7,4 - 6,1 = 1,3
(Cs / Ca) = 10 1,3 = 20
Questo rapporto non e' ottimale per il potere tampone; pero'
1) l'anidride carbonica e' costantemente prodotta dal metabolismo, nella misura di circa 20 moli al giorno (!);
2) e' costantemente eliminata dal polmone con la respirazione (e' un gas);
3) il bicrabonato e' eliminato dal rene con l'urina, e questo ne controlla la concentrazione.
A causa di questi meccanismi di controllo le concentrazioni del bicarbonato e dell'anidride carbonica sono mantenute assai costanti e il rapporto Cs / Ca (cioe' [HCO3-]/[CO2 aq]) varia di pochissimo; questo rende il tampone bicarbonato-anidride carbonica molto piu' efficace in vivo di quanto lo sarebbe in vitro.
Il pH del tampone bicarbonato-anidride carbonica risente della respirazione in questo modo: nel polmone viene eliminata dal sangue la CO2; questo e' l'acido del tampone e in conseguenza della sua eliminazione la reazione di dissociazione si sposta verso sinistra, con alcalinizzazione del sangue. Per contro nei tessuti la CO2 viene prodotta e riversata nel sangue; la concentrazione dell'acido aumenta e l'equilibrio di dissociazione si sposta verso destra, acidificando il sangue. Queste variazioni dell'equilibrio acido base possono essere rappresentate come segue:

LA FUNZIONE TAMPONE DELL'EMOGLOBINA.
L'emoglobina e' la proteina responsabile del trasporto dell'ossigeno ed e' contenuta nei globuli rossi. Contribuisce al potere tampone del sangue in misura significativa, anche se inferiore a quella del bicarbonato. L'emoglobina e' composta da quattro catene polipeptidiche uguali a due a due e chiamate α e β. Ogni coppia α-β si comporta come un acido debole monoprotico; nel trattamento che segue si considerera' quindi come unita' funzionale ai fini del potere tampone il dimero α-β.
Il pKa dell'emoglobina varia nei due stati ossigenato (combinato con l'ossigeno) e desossigenato (non combinato con l'ossigeno):
| H-HbO2 + H2O <==> HbO2 + H3O+ | pKa = 7 |
| H-Hb + H2O <==> Hb + H3O+ | pKa = 7,8 |
Sono state intenzionalmente trascurate le cariche di queste molecole (cioe' non ho scritto Hb- ma Hb) perche' le proteine sono molecole molto grandi con numerose cariche sia positive che negative e quindi ho preferito trascurare questo punto). Per ciascuno dei due sistemi tampone e' possibile scrivere una equazione di Henderson e Hasselbalch, tenendo pero' presente che il pH del sangue e' lo stesso ed e' comune alle due equazioni:
pH = 7,8 + log ([Hb] / [H-Hb]) = 7 + log ([HbO2] / [H-HbO2])
Si osserva che la desossiemoglobina e' un acido piu' debole della ossiemoglobina, ed il suo pKa (7,8) e' un po' maggiore del pH del sangue: pertanto nel sangue la dessosiemoglobina rende ad acquistare ioni idrogeno ed e' prevalentemente presente nella forma dell'acido (H-Hb). Per contro per la ossiemoglobina vale l'opposto e la forma prevalente nel sangue e' quella della base coniugata, priva di ione idrogeno (HbO2). La reazione prevalente nei capillari polmonari, in presenza di un eccesso di ossigeno, e':
H-Hb + O2 + H2O <==> HbO2 + H3O+
Per contro, nei capillari sistemici (in difetto di ossigeno) si ha:
HbO2 <==> H-Hb + O2 + OH-
Il sistema bicarbonato-anidride carbonica acidifica il sangue nei capillari sistemici e lo alcalinizza nei capillari polmonari; il tampone dell'emoglobina funziona in modo opposto e la sinergia tra i due tamponi e' un ulteriore meccanismo inteso a minimizzare le variazioni del pH del sangue: ovvero, non solo nel sangue i due tamponi coesistono e lavorano ciascuno per suo conto, ma ciascuno corregge il pH in direzione opposta all'altro realizzando un sistema complessivo molto efficiente nel rendere piccolissime le oscillazioni del pH. Il funzionamento complessivo dei due principali tamponi del sangue puo' essere schematizzato come riportato nella figura seguente:
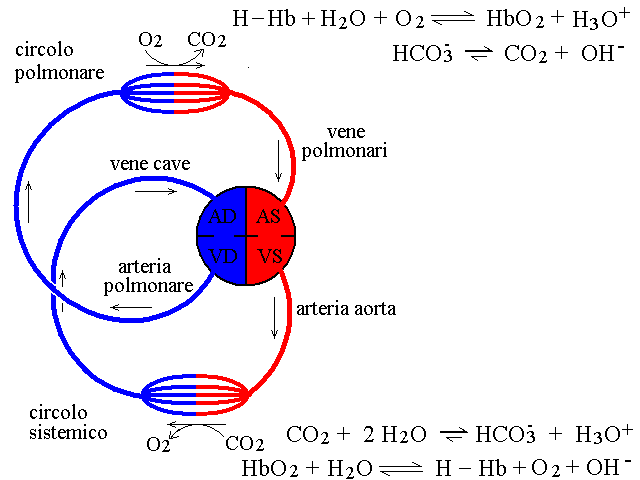
Il sistema del FOSFATO da un contributo minore alla stabilizzazione del pH del sangue. L'acido fosforico e' poliprotico e presenta tre dissociazioni successive; tra queste quella che esercita il ruolo di tampone nel sangue e' la seconda che presenta pKa = 7,2:
H2PO4- + H2O <==> HPO42- + H3O+
CONCETTI CLINICI.
A causa della complessita' degli equilibri acido-base del sangue e della loro dipendenza da fattori anatomo-fisiologici esterni al sangue quali la funzionalita' respiratoria e renale, in medicina si usano anche indicatori e misure "funzionali", i piu' rilevanti e diffusi tra i quali sono i seguenti:
- ECCESSO DI BASE (base excess; un concetto introdotto da Astrup e Siggaard Andersen nel 1958): il numero di mEq di acido forte necessario per riportare a 7,40 il pH di un litro di sangue equilibrato con 40 mmHg di CO2 e 150 mmHg di O2 alla temperatura di 37 gradi. Se il pH del sangue del paziente nelle condizioni date e' inferiore a 7,40 per riportarlo a questo pH e' necessaria base forte anziche' acido forte e la quantita' di base forte necessaria e' una misura del DIFETTO DI BASE (base deficit, si indica con il segno negativo). Il sangue dell'individuo sano ha un eccesso di base prossimo a zero (in genere si indicano come limiti i valori di +2 e -2 mEq/L).
- BICARBONATO STANDARD: la concentrazione dello ione bicarbonato nel plasma del paziente, misurato dopo aver equilibrato con 40 mmHg di CO2 e 150 mmHg di O2 alla temperatura di 37 gradi.
- ACIDOSI: la condizione nella quale il sangue arterioso del paziente presenta pH < 7,35. Puo' dipendere da un difetto respiratorio, nel qual caso l'eliminazione della CO2) e' impedita o diminuita e nel sangue aumentano sia l'anidride carbonica che il bicarbonato (ipercapnia). Oppure da un difetto metabolico (ad esempio produzione di acido acetoacetico e suoi derivati nel diabete mellito), nel qual caso il polmone mediante iperventilazione aumenta l'escrezione di CO2 con risultante diminuzione sia del bicarbonato che dell'anidride carbonica (ipocapnia). Puo' accadere che un efficiente compenso polmonare riesca a mantenere il pH > 7,35 a costo di evidenti alterazioni delle concentrazioni dei tamponi del sangue: si parla in questo caso di acidosi compensata.
- ALCALOSI: la condizione nella quale il sangue arterioso del paziente presenta pH > 7,45. Puo' dipendere da iperventilazione (dovuta a difetti neurologici del controllo della respirazione o al respirare aria a ridotto contenuto di ossigeno, come accade agli alpinisti ad alta quota), nel qual caso si ha ipocapnia; oppure da disturbi metabolici (ad es. vomito prolungato con perdita di HCl) nel qual caso si ha ipercapnia.
Esistono acidi che possono cedere piu' di un solo ione idrogeno e basi che possono accettarne piu' di uno solo. In entrambi i casi questi elettroliti possono essere forti o deboli e, se sono deboli, presentano tante costanti di dissociazione quanti sono i loro gruppi ionizzabili. Ad esempio:
H2SO4 + 2 H2O --> SO4-2 + 2 H3O+
H2C2O4 + 2 H2O <==> HC2O4- + H3O+ + H2O <==> C2O4-2 + 2 H3O+
Mg(OH)2 --> Mg+2 + 2 OH-
C4H12N2 + 2 H2O <==> C4H13N2+ + H2O + OH- <==> C4H14N2+2 + 2 OH-
BASI FORTI POCO SOLUBILI
Le soluzioni di acidi e basi sono tollerate dai tessuti del nostro organismo (ad esempio nell'alimentazione) soltanto se la loro acidita' o basicita' sono modeste; le soluzioni concentrate di acidi o basi sono caustiche e, per contatto cutaneo o ingerite producono delle gravi lesioni tissutali. Come conseguenza non e' possibile somministrare a scopo terapeutico ne' soluzioni di acidi o basi forti, ne' soluzioni concentrate di acidi o basi deboli.
Alcuni composti comunemente impiegati nel trattamento sintomatico dell'iperacidita' gastrica sono basi forti poco solubili, che hanno grande basicita' potenziale (perche' possono rilasciare molto ione idrossido se si sciolgono tutte), ma pH solo debolmente basico (perche' si sciolgono solo in minima parte). I composti di questo genere sono in genere basi polifunzionali: idrossidi di metalli bivalenti o trivalenti, quali l'idrossido di magnesio (comunemente chiamato magnesia: Mg(OH)2) o l'idrossido di alluminio (Al(OH)3; la miscela degli idrossidi di magnesio e alluminio si vende in farmacia col nome di maalox). Come esempio di questa classe di composti e delle sue reazioni, consideriamo l'idrossido di magnesio:
Mg(OH)2 solido <==> Mg+2aq + 2 OH-
Come per tutti i composti poco solubili, anche per l'idrossido di magnesio possiamo definire una costante prodotto di solubilita':
Kps = [Mg+2] [OH-]2 = 4 S3 = 1,2 x 10-11 M3
Dove S indica la concentrazione della soluzione satura. Per calcolare il pH della soluzione satura si fa in primo luogo l'ipotesi che sia possibile trascurare lo ione idrossido proveniente dall'autoprotolisi dell'acqua e si ottiene:
[OH-] = 2 S = 2 (Kps / 4)1/3 = 2,9 x 10-4 M
pOH = -log [OH-] = 3,54
pH = pKW - pOH = 10,46
A posteriori si verifica che l'approssimazione che ci ha suggerito di tracsurare il contributo alla [OH-] dell'autoprotolisi dell'acqua era corretta: infatti la concentrazione dello ione idrossido rilasciato dalla base (2,9 x 10-4 M) e' molto maggiore di quella dovuta all'acqua, il cui contributo e' quindi effettivamente trascurabile.
L'acidita' dello stomaco, sottraendo ione idrossido alla soluzione grazie alla reazione H3O+ + OH- --> 2 H2O , causa la dissociazione di ulteriore base dal corpo di fondo e quindi si neutralizza da se stessa.
SALI POCO SOLUBILI DEGLI ACIDI DEBOLI.
Anche questo e' un caso molto interessante per la medicina, per due ragioni:
1) la matrice minerale dell'osso e' costituita da fosfato di calcio, un sale poco solubile dell'acido fosforico (che e' un acido debole)
2) il 90% dei calcoli urinari e' costituito almeno in parte da ossalato di calcio (un altro sale poco solubile di acido debole).
Esistono inoltre altre applicazioni, di minore importanza medica. Considereremo l'esempio dell'ossalato di calcio, relativamente semplice, perche' consente alcune considerazioni rilevanti.
L'acido ossalico e' un acido diprotico debole, che ha la formula e le reazioni seguenti:
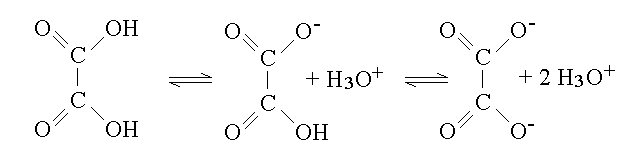
Per semplicita' nel trattamento che segue useremo le formule brute H2C2O4, HC2O4- e C2O4-2. L'ossalato di calcio e' un sale poco solubile, di formula CaC2O4; per semplicita' assumeremo che non si formi affatto il sale acido, di formula Ca(HC2O4)2.
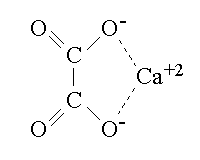
Le due reazioni di ionizzazione dell'acido ossalico presentano le costanti:
Ka, 1 = 5,9 x 10 -4 M ; Ka, 2 = 6,4 x 10 -5 M
Il prodotto di solubilita' dell'ossalato di calcio e':
Kps = [C2O4-2] [Ca+2] = 1,3 x 10-9 M2
Supponiamo che 100 mL di urina a pH = 7 contengano 2 mMoli di ossalato totale e 1 mMole di ione calcio totale:
H2C2O4 + HC2O4- + C2O4-2 + CaC2O4 = 2 mMoli
Ca+2 + CaC2O4 = 2 mMoli
Per effettuare il calcolo completo degli equilibri ionici in soluzione in queste condizioni si procede come segue. In primo luogo calcoliamo quale sia il rapporto tra le concentrazioni delle specie solubili dell'ossalato, utilizzando le due Ka ed il pH (noto) del campione:
Ka, 1 = 5,9 x 10 -4 M = [HC2O4-] [H3O+] / [H2C2O4]
[HC2O4-] / [H2C2O4] = Ka, 1 / [H3O+] = 5,9 x 103
Il calcolo dimostra che a pH = 7 ([H3O+] = 10-7 M) lo ione HC2O4- e' 5900 volte piu' concentrato dell'acido indissociato H2C2O4. Analogamente:
Ka, 2 = 6,4 x 10 -5 M = [C2O4-2] [H3O+] / [HC2O4-]
[C2O4-2] / [HC2O4-] = Ka, 2 / [H3O+] = 6,4 x 102
A pH = 7 lo ione C2O4-2 e' 640 volte piu' concentrato dello ione HC2O4-. Questi calcoli dimostrano quindi che i rapporti tra le concentrazioni delle specie solubili dell'ossalato sono i seguenti: [H2C2O4]:[HC2O4-]:[C2O4-2] = 1 : 5900 : (5900x640) = 1 : 5.900 : 3.776.000 . In pratica l'unica specie presente in concentrazione significativa e' lo ione C2O4-2.
Dato il Kps molto basso, e dato che lo ione calcio e' in difetto, possiamo assumere che lo ione calcio sia presente soprattutto nel precipiatto e che la sua concentrazione in soluzione sia trascurabile; Questo suggerisce che il precipitato corrisponda a 1 mMole di CaC2O4 e che sia presente in soluzione (2-1) = 1 mMole di ione C2O2-2. Le concentrazioni di tutte le specie presenti in 100 mL di urina risultano pertanto:
| specie | moli totali presenti | moli in soluzione | concentrazione |
| [H3O+] | 10-7 M | ||
| CaC2O4 | 0,001 | 0 | 0 |
| C2O4-2 | 0,001 | 0,001 | 0,01 M |
| HC2O4- | 0,001 / 640 = 1,56 x 10-6 | 1,56 x 10-6 | 1,56 x 10-5 M |
| H2C2O4 | 1,56 x 10-6 / 5900 = 0,26 x 10-9 | 0,26 x 10-9 | 2,6 x 10-9 M |
| Ca+2 | 0 | 0 | Kps / [C2O4-2] = 1,3 x 10-7 M |
Le concentrazioni delle specie Ca+2, HC2O4- e H2C2O4 sono molto basse o nulle e questo conferma che l'approssimazione per cui il precipitato ammonta ad 1 mMole di CaC2O4 era accettabile. Inoltre a questo pH la precipitazione del sale e' pressoche' completa.
Torna a: didattica; Medicine non Scientifiche; Biblioteca Digitale.