PRIMA FACOLTA' DI MEDICINA E CHIRURGIA - CLM "B"
SAPIENZA UNIVERSITA' DI ROMA
Le reazioni di ossido-riduzione comportano il trasferimento di elettroni da un donatore (il riducente) ad un accettore (l'ossidante). Il trasferimento di elettroni e' evidente quando e' completo (ad esempio quando due elementi nel loro stato elementare si combinano per formare un composto ionico). Ad es. nella reazione
4 Na + O2 --> 2 Na2O
gli atomi dei reagenti hanno carica netta uguale a zero mentre il prodotto e' una molecola ionica formata da ioni Na+ e ioni ossido O-2. Lo stesso avviene nell'ossidazione dei metalli da parte degli acidi:
2 H3O+ + Fe --> H2 + 2 H2O + Fe+2
In questa reazione il ferro metallico cede due elettroni a due ioni idorgeno (che vengono convertiti in una molecola di idrogeno gassoso) e si trasforma nello ione ferroso.
Quando il trasferimento elettronico e' soltanto parziale (cioe' quando il prodotto e' una molecola polare ma non ionica) l'ossido-riduzione puo' essere ugualmente presente ma e' meno evidente. Ad es.:
H2 + Cl2 --> 2 HCl
In questa reazione due legami covalenti omopolari (H-H e Cl-Cl) si trasformano in due legami fortemente eteropolari (H-Cl) con trasferimento parziale di un elettrone da H a Cl).
Per semplificare l'analisi del trasferimento di elettroni (soprattutto in quei casi nei quali non e' evidente), si assegna ad ogni atomo in ogni molecola dei reagenti e dei prodotti una carica fittizia, il suo numero di ossidazione (n.o.); una reazione e' una ossido-riduzione se due o piu' atomi cambiano il loro numero di ossidazione (non e' possibile che sia un solo atomo a cambiare il suo numero di ossidazione perche' questo violerebbe il principio di conservazione della carica).
Il numero di ossidazione e' la carica che l'atomo avrebbe se i legami covalenti presenti nella molecola fossero trasformati in legami ionici. Ad esempio nella molecola di HCl che presenta un legame fortemente polare, la carica formale dell'idrogeno e' +1 e quella del cloro e' -1: n.o.=1H - Cln.o.=-1.
Per assegnare ad ogni atomo di una molecola il suo numero di ossidazione si puo' procedere in due modi:
1) si scrive la formula di struttura, si considera ogni legame tra atomi diversi come se fosse ionico e si assegnano gli elettroni di legame all'atomo piu' elettronegativo (tenendo conto che in genere uno era gia' suo mentre l'altro veniva dall'altro atomo).
2) si considera la sola formula bruta e si applicano le seguenti regole:
2a) la somma dei n.o. deve corrispondere alla carica netta totale della molecola o dello ione considerato;
2b) ogni elemento nel suo stato elementare ha n.o. = 0
2c) l'idrogeno ha n.o. = +1 in tutti i composti tranne H2 dove ha n.o. = 0 (per la regola 2b) e negli idruri metallici dove ha n.o. = -1.
2d) l'ossigeno ha n.o. = -2 in tutti i composti tranne O2 dove ha n.o. = 0 e i perossidi dove ha n.o. = -1
2e) i metalli alcalini (I gruppo della tavola periodica) hanno sempre n.o. = +1 tranne che nel loro stato metallico dove hanno n.o. = 0
2f) i metalli alcalino-terrosi (II gruppo) hanno sempre n.o. = +2 tranne che nel loro stato metallico dove hanno n.o. = 0.
ESEMPI DEL CALCOLO DEL NUMERO DI OSSIDAZIONE:
NH3: H ha n.o. = +1; la molecola ha carica netta uguale a zero quindi N ha n.o. = -3 e -3 + 1x3 = 0.
H2SO4: H ha n.o. = +1; O ha n.o. = -2; la molecola ha carica netta uguale a zero quindi S ha n.o. = +6 e 6 + 1x2 -2x4 = 0.
CO2: O ha n.o. = -2; la molecola ha carica netta uguale a zero quindi C ha n.o. = +4
HCO3-: H ha n.o. = +1; O ha n.o. = -2; lo ione poliatomico ha carica netta -1 quindi C ha n.o. = +4 e 4 + 1 -2x3 = -1
CH4: H ha n.o. = -1; la molecola ha carica netta uguale a zero, quindi C ha n.o. = -4.
Esempio di calcolo del numero di ossidazione dalla formula di struttura: l'acido nitroso ha la formula di struttura H-O-N=O nella quale vanno considerati singolarmente i legami chimici. Il legame H-O e' covalente polare quindi l'idrogeno (meno elettronegativo) cede il suo elettrone all'ossigeno (piu' elettronegativo; si consultino i valori di elettronegativita' riportati nella tavola periodica); l'idrogeno ha quindi n.o.=+1. Il legame O-N e' covalente polare e l'azoto cede un elettrone all'ossigeno; quindi, tenendo conto anche del reagionamento precedente, l'ossigeno ha n.o.=-1-1=-2. Il doppio legame N=O e' covalente polare e quindi l'azoto cede due elettroni all'ossigeno (uno attraverso il legame sigma, l'altro attraverso il legame pi); tenendo conto del ragionamento precedente si ottiene: N ha n.o.=+1+2=+3; O ha n.o.=-2. La somma dei n.o. risulta: +1-2+3-2=0, corretta per gli atomi di una molecola priva di carica netta.
Due molecole nelle quali lo stesso atomo compare con n.o. diverso costituiscono una coppia ossido-riduttiva (o redox), purche' possano essere rispettivamente il reagente ed il prodotto di una sola reazione di ossido-riduzione. Sono esempi di coppie redox:
Cl2 / Cl- e H2 / H+ nella reazione Cl2 + H2 --> 2 HCl
Fe / Fe+2 e H2 / H+ nella reazione Fe + 2 H+ --> Fe+2 + H2
Cl2 / Cl- e Fe+3 / Fe+2 nella reazione 2 Fe+2 --> 2 Fe+3 + 2 Cl-
Alcuni elementi fanno due coppie redox (e talvolta anche di piu', ma la coppia non e' mai tra gli stati di ossidazione estremi: ad esempio il ferro fa almeno due coppie redox (in realta' di piu' ma le altre sono meno comuni): Fe / Fe+2 e Fe+3 / Fe+2, ma non c'e' coppia redox tra Fe e Fe+3; se noi mescoliamo Fe e Fe+3 (ad es. nella forma del cloruro ferrico FeCl3) si osserva la seguente reazione di ossido-riduzione:
Fe + 2 Fe+3 --> 3 Fe+2
nella quale il ferro metallico si ossida a ferro ferroso (Fe+2) ed il ferro ferrico (Fe+3) si riduce a ferro ferroso; le coppie redox sono quindi Fe / Fe+2 e Fe+3 / Fe+2. La reazione e' praticamente irreversibile e consuma tutto il reagente in difetto; alla fine ci si ritrovera' con una sola coppia redox del ferro (Fe / Fe+2 se era in difetto Fe+3; oppure Fe+3 / Fe+2 se era in difetto Fe).
UNA REAZIONE DI OSSIDO-RIDUZIONE COMPORTA LO SCAMBIO DI UNO O PIU' ELETTRONI TRA DUE COPPIE REDOX.
La teoria delle ossido-riduzioni e' analoga alla teoria degli acidi e delle basi di Bronsted e Lowry: nella prima si ha lo scambio di uno o piu' elettroni tra un donatore (il riducente) e un accettore (l'ossidante); nella seconda lo scambio di uno ione idrogeno tra un donatore (l'acido) e un accettore (la base). In effetti la teoria di Bronsted e Lowry fu modellata su quella delle ossido-riduzioni. E' importante notare una differenza: gli ioni idrogeno devono essere scambiati uno solo alla volta mentre gli elettroni possono essere scambiati anche due o tre per volta. Si consideri il seguente esempio:
n.o.=0O2 + 2 n.o.=0H2 --> n.o.=+1H2On.o.=-2
In questa reazione l'idrogeno e' il donatore di elettroni e l'ossigeno ne e' l'accettore; le coppie sono H2 / H2O e O2 / H2O . Infatti si ha:
Idrogeno: n.o.=0 in H2; n.o.=+1 (formalmente corrispondente allo ione H+) in H2O
Ossigeno: n.o.=0 in O2; n.o.=-2 (formalmente corrispondente allo ione ossido, O-2) in H2O
STATI OSSIDATI E RIDOTTI. Il membro di una coppia redox che presenta il numero di ossidazione piu' basso (meno positivo o piu' negativo) e' quello piu' ricco di elettroni e si chiama lo stato (o specie o forma) ridotto della coppia; quello che presenta il numero di ossidazione piu' alto (piu' positivo o meno negativo) e' quello piu' povero di elettroni e si chiama lo stato ossidato. Ad esempio nella reazione precedente le coppie erano H2 / H2O per l'idrogeno e O2 / H2O per l'ossigeno; in queste:
H2 e' lo stato ridotto dell'idrogeno (con n.o.=0) e H2O (che contiene formalmente lo ione H+ ed ha quindi n.o.=+1) ne e' lo stato ossidato
O2 e' lo stato ossidato dell'ossigeno (con n.o.=0) e H2O (che contiene formalmente lo ione O-2 ed ha quindi n.o.=-2) ne e' lo stato ridotto.
OSSIDANTI E RIDUCENTI. Riassumendo quanto detto finora, la reazione redox comporta uno scambio di elettroni tra un donatore, che e' la specie ridotta della prima coppia redox, ed un accettore che e' la specie ossidata della seconda coppia redox. I prodotti di reazione sono la specie ossidata della prima coppia redox e la specie ridotta della seconda. Consegue che la specie ridotta della prima coppia redox riduce la specie ossidata della seconda ed e' pertanto chiamata il riducente; nel corso della reazione si ossida. Allo stesso tempo la specie ossidata della seconda coppia redox ossidala specie ridotta della prima ed e' pertanto chiamata l'ossidante; nel corso della reazione si riduce.
SEMIREAZIONI. Gli elettroni (come gli ioni idrogeno) non si trovano mai isolati; ciononostante si possono scrivere le reazioni redox dividendole in due semireazioni, una di ossidazione e l'altra di riduzione, ciascuna a carico di una sola coppia redox.Ogni reazione redox deve contenere due di tali semireazioni, in una delle quali (quella di ossidazione) gli elettroni appaiono tra i prodotti, nell'altra (riduzione) tra i reagenti. Ad esempio:
O2 + 2 H2 --> 2 H2O
viene scomposta in:
semirazione di ossidazione: 2 H2 --> 4 H+ + 4 e-
semirazione di riduzione: O2 + 4 e- --> 2 O-2
E' sempre preferibile (ma non obbligatorio) scrivere le semireazioni della stessa reazione redox in forma bilanciata, cioe' avendo cura che gli elettroni liberati nella semireazione di ossidazione siano lo stesso numero di quelli utilizzati nella semireazione di riduzione (ovvero avrei potuto scrivere l'ossidazione come H2 --> 2 H+ + 2 e- ma ho preferito invece moltiplicare per 2 e bilanciare gli elettroni con quelli necessari alla riduzione).
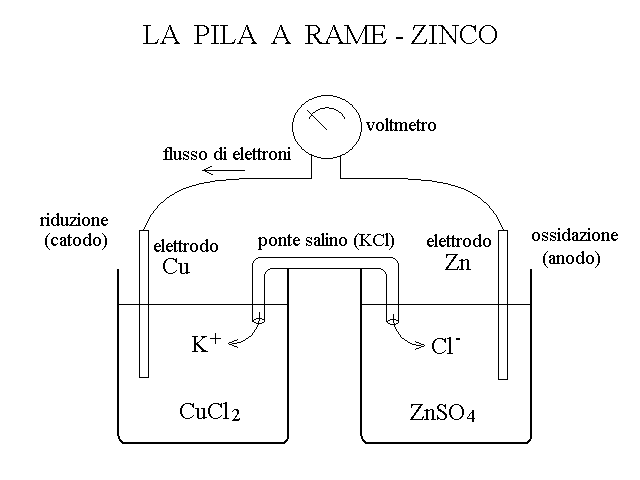
In alcuni casi e' possibile separare le due semireaizone di una ossidoriduzione e far passare i soli elettroni dall'una all'altra attraverso un filo conduttore metallico. Ad esempio la reazione:
Zn + Cu+2 --> Zn+2 + Cu
puo' essere scomposta nelle due semireazioni:
Zn --> Zn+2 + 2 e-
Cu+2 + 2 e- --> Cu
Le due coppie Cu/Cu+2 e Zn/Zn+2 sono separate in contenitori distinti (semicelle), ma connessi da un filo metallico e sono i soli elettroni a trasferirsi dallo zinco al rame attraverso il filo. Pertanto la reazione puo' avvenire anche in assenza del mescolamento diretto tra ossidante e riducente.
POTENZIALI DI OSSIDO-RIDUZIONE
La tendenza di ogni elemento ad ossidarsi o a ridursi ha a che fare con la sua elettronegativita', affinita' elettronica ed energia di ionizzazione, e puo' essere misurata sfruttando una pila. Essa corrisponde al potenziale elettrostatico che la coppia e' in grado di generare. Poiche' pero' la reazione redox (e la pila) richiedono due coppie redox, mentre il potenziale di interesse e' quello di ogni singola coppia redox, e' necessario utilizzare una coppia di riferimento e misurare la tendenza di ogni elemento a ossidarsi o ridursi rispetto a quella. Come riferimento si usa per convenzione la coppia H+/H2, alla quale viene assegnato il potenziale convenzionale di 0 Volt.
Per determinare il potenziale ossido-riduttivo standard di ogni coppia redox, occorre utilizzare la coppia in questione per costruire una pila che contenga in una semicella la coppia in questione e nell'altra la coppia di riferimento. La differenza di potenziale che si misura tra i due elettrodi corrisponde allora al potenziale standard della prima coppia in quanto quello della seconda e' per convenzione uguale a zero.
Il potenziale redox viene espresso per la reazione di riduzione (acquisto di elettroni); un potenziale negativo indica tendenza a cedere gli elettroni all'elettrodo di riferimento (a idrogeno), uno positivo tendenza ad acquistare elettroni sottraendoli all'elettrodo di riferimento. Si noti che questa convenzione, essendo gli elettroni negativi, assegna (in modo molto logico) potenziale negativo alle coppie che respingono gli elettroni, e positivo a quelle che li attraggono. La scala dei potenziali redox e' riportata in tabelle ordinate per il potenziale, nella forma:
| coppia redox e semirezione | potenziale standard |
| Li+ + e- --> Li | -3,02 V |
| ... | ... |
| F2 + 2 e- --> 2 F- | +2,80 V |
Un potenziale redox standard positivo indica che a condizioni standard l'elemento considerato, nella semireazione considerata, sottrae elettroni all'idrogeno e lo ossida (cioe' converte H2 in 2 H+); un potenziale negativo indica che l'elemento riduce l'idrogeno (cioe' converte 2 H+ in H2).
EQUAZIONE DI NERNST
L'equazione di Nernst consente di calcolare il potenziale redox di semicella, in condizioni diverse da quelle standard:
E = E0 + (RT / nF) ln ([specie ossidata]o / [specie ridotta]r)
In questa equazione l'esponente (o/r) indica il coefficiente stechiometrico della specie considerata nella semireazione; R e' la costante dei gas espressa pero' nella forma del lavoro elettrico (V.A); n e' il numero di elettroni scambiati nella semireazione e F e' il numero di Faraday (cioe' la carica associata ad un numero di Avogadro di elettroni, pari a 96500 Coulomb). E risulta misurato in Volt e costituisce il potenziale di semicella. Il termine RT/F e' costante (se si usa la temperatura standard di 298 K) e, moltiplicato per il fattore di conversione dei logaritmi dalla base naturale a quella decimale, vale 0,06; questo porta alla formula semplificata:
E = E0 + 0,06/n log ([specie ossidata]o / [specie ridotta]r)
FORZA ELETTROMOTRICE (f.e.m.). La forza elettromotrice dalla pila e' data dalla differenza tra i potenziali di semicella e non puo' mai essere minore di zero. Per calcolarla si applica l'equazione di Nernst a ciascuna delle due semicelle e si ottengono i due potenziali E1 ed E2; poi si sottrae il minore dal maggiore per ottenere: f.e.m. = E1 - E2 (supponendo che E1 > E2). Se le due semireazioni scambiano lo stesso numero di elettroni e' anche possibile sottrarre l'una dall'altra le due equazioni di Nernst delle semicelle ed ottenere l'equazione di Nernst dell'intera pila elettrochimica:
f.e.m. = E1 - E2 = E0,1 - E0,2 + 0,06/n log ([specie ossidata1]o [specie ridotta2]r / [specie ridotta1]r [specie ossidata2]o)
Poiche' i termini delle concentrazioni compaiono in un logaritmo e questo e' moltiplicato per il numero (piccolo) 0,06, in pratica e' abbastanza raro che la f.e.m. sia significativamente diversa dalla differenza tra gli E0: questo accade quando le concentrazioni delle specie chimiche sono straordinariamente grandi o straordinariamente piccole e nelle pile a concentrazione (vedi oltre).
FUNZIONE DEL PONTE SALINO. Il funzionamento della pila richiede la presenza di un ponte salino che colleghi le due semicelle. Infatti, quando si chiude il circuito elettrico, l'anodo cede elettroni (cioe' cariche negative) al catodo, attraverso il filo metallico che collega i due elettrodi. Questo comporta che la semicella dell'anodo tende ad assumere carica positiva, quella del catodo carica negativa: si instaura cioe' una differenza di potenziale elettrostatico tra i ude elettrodi che ha verso opposto alla differenza del potenziale elettrochimico. In assenza del ponte salino, dopo brevissimo tempo, la differenza del potenziale elettrostatico diventerebbe uguale a quella del potenziale elettrochimico e il flusso degli elettroni sarebbe arrestato. Il ponte salino cede ioni di segno positivo o negativo, che sono attratti dalla carica elettrostatica netta vigente nelle semicelle, e questi neutralizzano la differenza di potenziale elettrostatico man mano che questa tende a formarsi, permettendo di protrarre il funzionamento della pila.
PILE A CONCENTRAZIONE.
L'equazione di Nernst dimostra che e' possibile produrre corrente anche utilizzando una pila le cui due semicelle contengono la stessa coppia redox, purche' le concentrazioni siano diverse; in questo caso la differenza tra gli E0 e' nulla e la f.e.m. della pila risulta:
f.e.m. = 0,06/n log ([specie ossidata1]o [specie ridotta2]r / [specie ridotta1]r [specie ossidata2]o)
Un caso particolare di pila a concentrazione e' la pila a idrogeno, nella quale la coppia e' H+/H2 e la specie ridotta in entrambe le semicelle e' il gas H2 che gorgoglia attraverso un elettrodo inerte di platino alla pressione di 1 atm; i termini [specie ridotta1] e [specie ridotta2] sono uguali e quindi l'equazione di Nernst della pila si riduce a:
f.e.m. = 0,06/1 log ([H3O+ 1] / [H3O+ 2]) = 0,06 (pH2 - pH1)
MISURA POTENZIOMETRICA DELLA CONCENTRAZIONE DI IONI. Una applicazione importante delle pile e' la misura della concentrazione di ioni per i quali e' possibile stabilire una semireazione di ossidoriduzione. Si consideri ad esempio la pila ad idrogeno analizzata sopra: se noi costruiamo una pila di questo genere utilizzando una semicella della quale il pH e' noto (ad es. una soluzione di HCl 0,1 M nella semicella 1 che ci dara' pH1 = 1) e' possibile misurare la f.e.m. e da questa determinare il pH della soluzione presente nell'altra semicella che risulta:
pH2 = (f.e.m. + 0,06 pH1) / 0,06
Nel laboratorio clinico i metodi potenziometrici sono utilizzati per la determinazione della concentrazione di molti degli elettroliti presenti nel sangue. Si deve inoltre considerare che una notevole semplificazione sperimentale e' possibile ricorrendo ad elettrodi a membrana che scambiano tra loro alcuni ioni in modo selettivo: ad esempio il pHmetro possiede un elettrodo che scambia ione H+ con ione K+ ed e' quest'ultimo ad essere effettivamente misurato al posto del primo (con il vantaggio di non aver bisogno di una bombola di idrogeno gassoso connessa all'elettrodo).
REAZIONI DI OSSIDO-RIDUZIONE CHE NON POSSONO AVVENIRE NELLE PILE. E' sempre possibile scomporre una reazione di ossido-riduzione in due semireazioni teoriche, ma non e' sempre possibile ottenere due semireazioni realizzabili in pratica ed utilizzabili in una pila elettrochimica. Di conseguenza non e' sempre possibile ricavare l'energia di una reazione redox attraverso una pila o misurare con metodi potenziometrici la concentrazione di una sostanza capace di ossido-riduzione. Un esempio di reazione di questo tipo e' la combustione del metano:
CH4 + 2 O2 --> CO2 + 2 H2O
Il calcolo dei numeri di ossidazione di ciascun elemento ci dimostra che la reazione e' una ossidoriduzione e che le coppie redox sono C-4/C+4 (oppure C in CH4/C in CO2) e O0/O-2 (oppure O in O2/O in H2O e in CO2). Quando scriviamo le semireazioni per le coppie CH4/CO2 e O2/CO2, ci accorgiamo subito che queste contengono un termine comune e non possono essere separate; ovvero, anche se in teoria possiamo scrivere:
C-4 --> C+4 + 8 e-
O2 + 4 e- --> 2 O-2
in pratica non possiamo separare la specie chimica che contiene il C+4 (la CO2) da una di quelle che contengono lo ione ossido O-2 (la stessa CO2). Questo implica che le semireazioni non possono essere separate e non possono essere fatte avvenire in due distinte semicelle. Il problema e' rilevante dal punto di vista tecnologico perche' il rendimento termodinamico della pila e' circa il 95% mentre quello della combustione e' soltanto del 30%: se fosse possibile generare energia elettrica facendo avvenire la combustione del metano in una pila se ne otterrebbe molta di piu' che in una centrale termoelettrica convenzionale.
Il metabolismo degli esseri viventi e' largamente basato su reazioni di ossido-riduzione perche' queste liberano grandi quantita' di energia. Per tutti gli animali, l'accettore finale degli elettroni (ossidante terminale) e' l'ossigeno atmosferico che viene ridotto a ione ossido (O-2), in genere all'interno di compotsi quali H2O o di CO2. Un esempio di riduzione biologica e' il seguente:
CH3-CH2-OH + NAD+ --> CH3-CHO + NADH + H+
In questa reazione il n.o. del primo carbonio dell'etanolo (da destra) passa da -1 a +1 con perdita di due elettroni e due ioni idrogeno; i due elettroni ed uno dei due ioni idrogeno vengono ceduti ad una molecola organica complessa (sigla: NAD+), mentre il secondo ione idrogeno va nel solvente e si idrata ad H3O+.
Torna a: didattica; Medicine non Scientifiche; Biblioteca Digitale.