PRIMA FACOLTA' DI MEDICINA E CHIRURGIA - CLM "B"
SAPIENZA UNIVERSITA' DI ROMA
I GLICIDI
I glicidi, chiamati anche zuccheri o saccaridi o carboidrati sono composti molto importanti per il metabolismo delle cellule. Hanno (spesso) la formula generale Cn(H2O)m alla quale si deve il nome di carboidrati o idrati di carbonio (come se fossero composti di carbonio e acqua, cosa ovviamente non vera). I glicidi sono presenti in natura nella forma di singole molecole contenenti da 3 a 7 (raramente fino a 9) atomi di carbonio (dette monomeri o monosaccaridi), oppure di polimeri o polisaccaridi (cioe' gruppi da alcune decine a molte migliaia di queste molecole legate chimicamente tra loro).
I monosaccaridi sono poli-idrossi aldeidi o poli-idrossi chetoni; i primi sono definiti aldosi, i secondi chetosi. I piu' importanti in biologia sono quelli con 3,5 e 6 atomi di carbonio.
I capostipiti delle due serie degli aldosi e dei chetosi sono due zuccheri a tre atomi di carbonio, la D-gliceraldeide e l'1,3 diidrossi acetone:
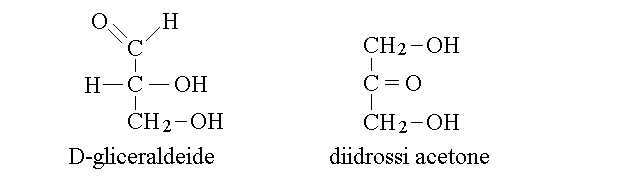
GLI ALDOSI
Il piu' semplice degli aldosi e' la gliceraldeide, che possiede tre atomi di carbonio ed ha la formula bruta C3H6O3; il nome IUPAC di questo composto e' 2,3 diidrossi propanale. Poiche' il secondo atomo di carbonio della catena e' asimmetrico, e da luogo al fenomeno dell'isomeria ottica, esistono due varianti di questa molecola, la L-gliceraldeide e la D-gliceraldeide; soltanto la seconda e' presente nel nostro organismo. Infatti, con l'eccezione del solo diidrossi acetone (un chetosio), tutti i monosaccaridi presentano uno o piu' carboni asimmetrici ed hanno quindi isomeri ottici. L'isomeria ottica negli zuccheri e' descritta secondo la convenzione di Fisher.
LA CONVENZIONE DI FISHER PER L'ISOMERIA OTTICA NEGLI ZUCCHERI. La convenzione di Fisher per scrivere il carbonio asimmetrico (gia' spiegata nelle lezioni sulla chimica organica) e' la seguente: si scrive la molecola con la catena carboniosa principale orientata dall'alto in basso e con il carbonio piu' ossidato in alto, e si adotta la convenzione che i sostituenti che si trovano in alto e in basso siano profondi rispetto al piano in cui si trova il carbonio asimmetrico. A causa dell'ibridazione sp3 del C asimmetrico, i sostituenti che si trovano a destra e a sinistra puntano ora verso l'osservatore. A questo punto il C asimmetrico ha la configurazione D se il sostituente orizzontale diverso dall'idrogeno si trova a destra e L se si trova a sinistra (per l'osservatore).
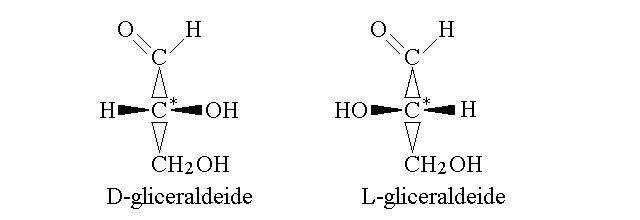
Tutti gli zuccheri utilizzati dal nostro organismo, sia aldosi che chetosi, con rarissime eccezioni) presentano la configurazione stereochimica D di Fisher per l'ultimo carbonio asimmetrico il penultimo della catena carboniosa), mentre e' variabile la configurazione degli altri carboni asimmetrici.
Il nome generico degli aldosi dipende dal numero di atomi di carbonio (espresso con la parola greca) della molecola: cosi' il ribosio e' un aldo-pentosio, il glucosio un aldo-esosio e cosi' via. Ogni aldosio presenta un numero di atomi di carbonio asimmetrico inferiore di due unita' al numero totale di atomi di carbonio (infatti sono simmetrici il primo e l'ultimo carbonio e asimmetrici quelli in mezz): quindi gli aldo-pentosi hanno tre carboni asimmetrici e gli aldo-esosi quattro. Di conseguenza sono possibili 8 (=23) aldo-pentosi diversi e 16 (=24) aldo-esosi; ma non tutti sono presenti negli organismi.
Gli aldosi piu' comuni nel nostro organismo hanno 5 o 6 atomi di carbonio: ad es. il ribosio, il glucosio ed il galattosio:
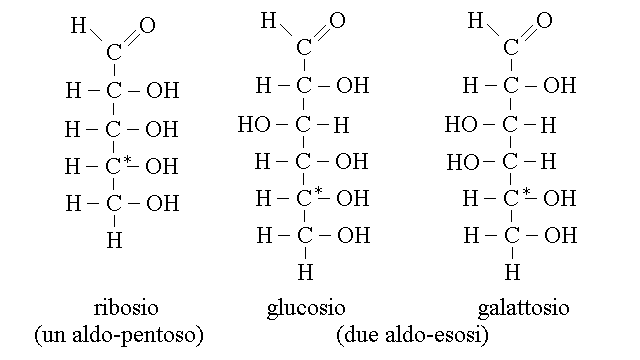
Si noti il rapporto tra il glucosio ed il galattosio: entrambi hanno la formula bruta C6H12O6 e sono quindi isomeri tra loro; in particolare le due molecole differiscono esclusivamente per la configurazione stereochimica del quarto atomo di carbonio che e' asimmetrico e sono quindi isomeri ottici rispetto ad uno solo dei loro quattro centri chirali.
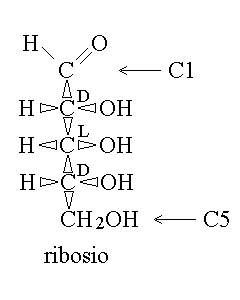
L'applicazione della convenzione di Fisher a zuccheri con piu' di tre atomi di carbonio risulta controintuitiva perche' quella che sembra la stessa posizione e' D sui carboni pari ed L su quelli dispari (o viceversa), a causa della costruzione a zig-zag di una serie di carboni con ibridazione sp3. Ad esempio nel ribosio hanno configurazione D i carboni 2 e 4 e configurazione L il carbonio 3, anche se la formula di Fisher dispone tutti i gruppi OH sulla destra. Questo e' evidente se si prova a scrivere la formula indicando quali legami puntano verso l'osservatore e quali invece se ne allontanano (si ricordi che per la convenzione di Fisher dovrebbero allontanarsi i legami in alto e in basso e avvicinarsi quelli a destra e a sinistra; questo succede per il C2 e il C4 del ribosio ma non per il C3 che si trova in una configurazione "anti-Fisher"). Il C1 e l'ultimo C (C5 nel ribosio) non sono invece asimmetrici).
FORME SEMIACETALICHE DEGLI ALDOSI. Gli aldosi con cinque o piu' atomi di carbonio possono assumere una configurazione ripiegata e chiudersi ad anello grazie alla formazione di un semiacetale interno alla molecola. Il risultato e' una molecola eterociclica non aromatica che assomiglia al tetraidrofurano nel caso degli aldo-pentosi e al tetraidropirano nel caso degli aldo-esosi (di qui i nomi di strutture furanosica e piranosica di questi zuccheri). In soluzione acquosa, quindi nelle condizioni dell'organismo, la struttura semiacetalica ciclica e' largamente preferita rispetto a quella aldeidica lineare. Poiche' le strutture cicliche degli zuccheri non sono aromatiche, esse non sono neppure planari; ad es. il gluco-piranosio (=glucosio in forma ciclica, piranosica) presenta l'isomeria a sedia e a barca come il cicloesano.
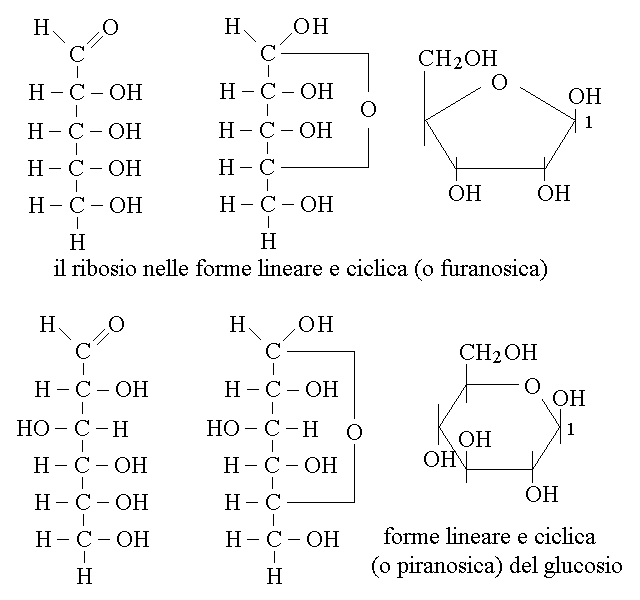
Le forme semiacetaliche dei monosaccaridi possono essere scritte secondo la convenzione di Fisher (e allora assomigliano molto alle forme aldeidiche o chetoniche da cui derivano) o secondo la piu' realistica coinvenzione di Haworth (che le rappresenta come poligoni regolari). Quale che sia la convenzione che si decide di adottare si deve ricordare che questa e' soltanto un diverso modo per rappresentare la stessa realta' fisica e non c'e' nessuna differenza tra il glucopiranosio di Fisher e quello di Haworth.
MUTAROTAZIONE. A seguito della formazione del semiacetale intra-molecolare, il C1 degli aldosi diventa asimmetrico e sono possibili due stereoisomeri ottici, chiamati α e β. Questi due stereoisomeri sono entrambi in equilibrio con la forma aldeidica, a catena aperta e pertanto si interconvertono nel fenomeno detto mutarotazione. La mutarotazione del glucopiranosio puo' essere cosi' rappresentata:
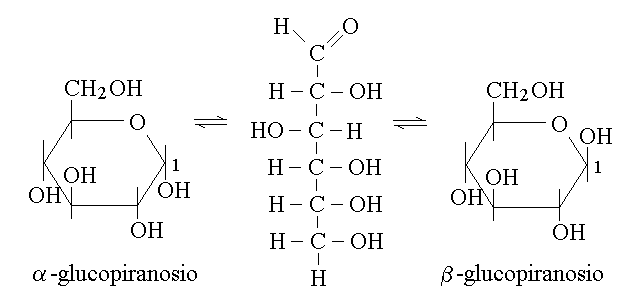
I CHETOSI
Gli zuccheri con la funzione chetonica sono chiamati chetosi. Qualunque sia il numero degli atomi di carbonio, la funzione chetonica si trova sul secondo carbonio della catena (posizione 2). Il piu' piccolo dei chetosi e' un cheto-triosio, il diidrossi acetone, unico zucchero che non presenta carboni asimmetrici e che quindi non ha isomeri ottici. Chetosi importanti sono il ribulosio (un cheto-pentosio) e il fruttosio (un cheto-esosio).
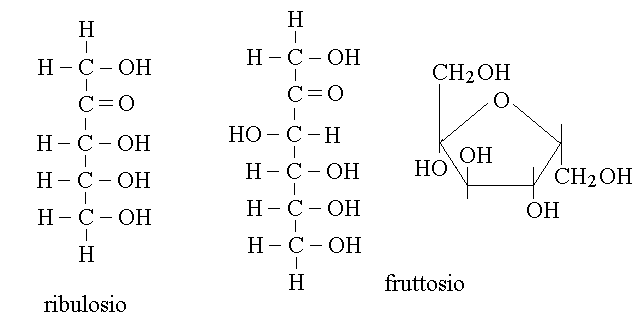
FORME SEMICHETALICHE DEI CHETOSI. Come gli aldosi formano legami semiacetalici intra-molecolari, cosi' anche i chetosi con almeno 6 atomi di carbonio possono formare semichetali intra-molecolari che danno luogo a strutture cicliche di tipo furanosico o piranosico (come, ad esempio, il fruttofuranosio, riportato nella figura qui sopra).
MONOSACCARIDI MODIFICATI
Gli aldosi e i chetosi possono andare incontro a reazioni chimiche che ne modificano la formula. Alcuni di questi monosaccaridi modificati hanno grande importanza in biologia e in medicina. Le principali modificazioni chimiche cui gli zuccheri possono andare incontro sono le seguenti:
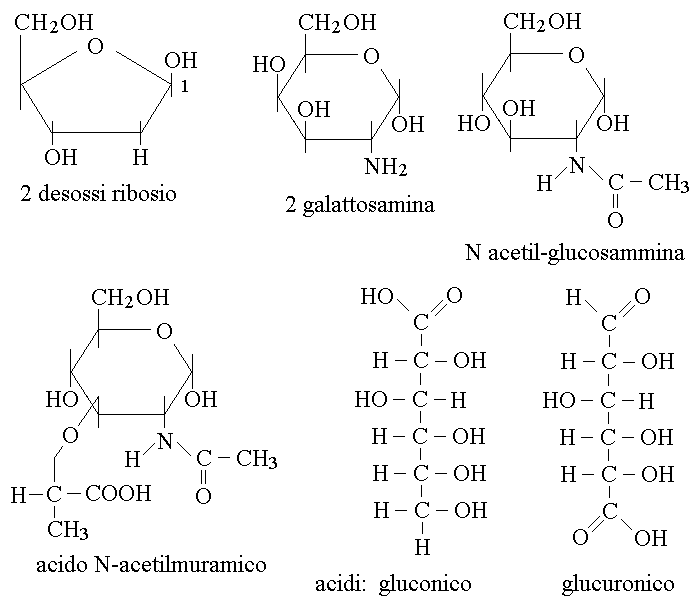
1) Riduzione di un gruppo alcolico: la riduzione di un gruppo alcolico da come prodotto un desossi-zucchero; il piu' importante esempio e' certamente quello del 2-desossi ribosio (lo zucchero del DNA), ma non e' l'unico: ad esempio e' un desossi-zucchero anche il fucosio (uno tra i pochissimi zuccheri presenti nel nostro organismo che presenta la forma L dell'ultimo carbonio chirale).
2) Riduzione del gruppo aldeidico o chetonico: produce un polialcol come l'inositolo, il sorbitolo o il ribitolo. Il caso piu' importante e' forse quello della riduzione del gruppo chetonico del diidrossi acetone, da cui si ottiene il glicerolo, l'alcol necessario alla biosintesi dei trigliceridi.
3) Ossidazione del gruppo aldeidico degli aldosi: produce l'acido aldonico. L'esempio piu' importante e' quello dell'acido gluconico, il prodotto di ossidazione del glucosio, con formula bruta C6H12O7. L'acido aldonico puo' formare un estere intramolecolare ciclico, chiamato un lattone, mediante la reazione del gruppo carbossilico in posizione 1 con l'OH del quinto carbonio. Nel caso dell'acido gluconico, il prodotto di questa reazione e' il glucono-lattone con formula bruta C6H10O6.
4) Ossidazione dell'ultimo atomo di carbonio degli aldosi o dei chetosi: produce l'acido alduronico o cheturonico. Il piu' importante e' l'acido glicuronico (o glucuronico), un altro prodotto di ossidazione del glucosio. E' importante notare che dal punto di vista della chimica organica, qualunque ossidante ossiderebbe prima il gruppo aldeidico degli aldosi; l'acido alduronico e' prodotto senza ossidare il gruppo aldeidico grazie alla presenza di enzimi specifici.
5) Ossidazione del primo e dell'ultimo atomo di carbonio degli aldosi: produce l'acido saccarico, che presenta due gruppi carbossilici.
7) Sostituzione di un gruppo alcolico con un gruppo aminico: si ottengono gli aminozuccheri come la 2-glucosamina e la 2-galattosamina. Spesso il gruppo aminico degli aminozuccheri nella cellula viene combinato con acido acetico e il prodotto e' un N-acetil aminozucchero (ad es. la N-acetil glucosamina).
Alcune formule di zuccheri modificati sono riportate nella figura seguente:
POLISACCARIDI
Gli zuccheri ad alto peso molecolare si chiamano polisaccaridi e sono plimeri dei monosaccaridi.
POLIMERI BIOLOGICI. Le macromolecole biologiche possono contenere molte migliaia di atomi, ma non sono sintetizzate atomo per atomo; sono invece polimeri, cioe' sono composte di molecole piu' piccole, sintetizzate atomo per atomo (i monomeri) e poi legate insieme. Sono caratteristici del polimero il tipo dei monomeri che lo costituiscono ed il legame che unisce i monomeri. I monomeri possono essere tutti uguali tra loro (ed allora il polimero prende il nome di omopolimero) oppure soltanto simili (negli eteropolimeri). Nel caso degli eteropolimeri i monomeri devono essere chimicamente simili abbastanza da poter formare il legame caratteristico del polimero e possono invece differire per parti della molecola non coinvolte in questo legame. Un esempio di omopolimero e' l'amido, costituito da molecole di glucosio tutte uguali tra loro e legate con legame glicosidico; esempi di eteropolimeri sono le proteine e gli acidi nucleici, costituiti rispettivamente da aminoacidi e da nucleotidi (le proteine sono polimeri di 20 diversi aminoacidi e gli acidi nucleici di 4 diversi nucleotidi)
LEGAME GLICOSIDICO. Il legame caratteristico dei polimeri degli zuccheri e' una forma particolare di acetale o chetale, che si forma tra il carbonio semiacetalico (o semichetalico) di un monosaccaride ed un carbonio qualunque di un altro monosaccaride. Ad esempio due molecole di glucopiranosio possono legarsi insieme formando un disaccaride chiamato maltosio, nel quale c'e' un legame glicosidico tra il gruppo semiacetalico sul C1 della prima molecola (in configurazione α) ed l'ossidrile sul C4 della seconda molecola; il legame si chiama α 1-4 glicosidico:
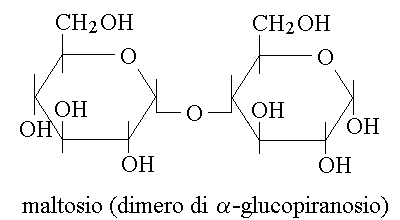
Mentre il semiacetale e' in equilibrio con l'aldeide (cioe' il glucopiranosio e' in equilibrio con la forma lineare del glucosio), l'acetale non puo' piu' tornare in equilibrio con la forma lineare: il legame glicosidico impedisce la mutarotazione e fissa lo zucchero nella configurazione (α o β) che aveva al momento in cui il legame si e' formato.
POLIMERIZZAZIONE TESTA-CODA. Nei polimeri biologici (ed in molti polimeri sintetici), i monomeri hanno una polarita' e si legano tra loro con un legame di tipo testa-coda; di conseguenza il polimero risultante mantiene la stessa polarita' dei suoi monomeri. Questo e' evidente, ad esempio, nel legame glicosidico del maltosio: ogni monomero di glucosio ha un C1 e un C4 ed il legame e' costituito in modo tale che il C1 si lega con il C4 del monomero successivo; pertanto il polimero ha la struttura C1-X-C4 - C1-X-C4 e mantiene quindi la polarita' del monomero, avendo ad una estremita' il C1 (del primo monomero) e all'altra estremita' il C4 (dell'ultimo monomero)
I QUATTRO DISACCARIDI IMPORTANTI PER L'ALIMENTAZIONE DELL'UOMO. Il cibo ingerito non puo' essere assorbito come tale, ma deve essere digerito. In termini biochimici digestione e' sinonimo di depolimerizzazione, cioe' di scomposizione dei polimeri contenuti negli alimenti in monomeri, e l'assorbimento e' possibile soltanto per i monomeri, non per i polimeri. Il sistema digerente possiede enzimi preposti alla digestione (=depolimerizzazione) ed in particolare possiede quattro disaccaridasi, cioe' quattro enzimi capaci di depolimerizzare i disaccaridi (polimeri costituiti da due soli monomeri). Consegue che soltanto quattro disaccaridi possono essere digeriti dal nostro intestino, mentre gli altri disaccardidi contenuti negli alimenti finiscono nelle feci. Le quattro disaccaridasi si chiamano maltasi, isomaltasi, saccarasi e lattasi e digeriscono rispettivamente il maltosio, l'isomaltosio, il saccarosio ed il lattosio. La carenza genetica o legata a difetti di sviluppo di una disaccaridasi comporta intolleranza per il disaccaride corrispondente e per tutti i polisaccaridi che lo producono nel corso della digestione. Le formule dei quattro disaccaridi importanti per l'alimentazione sono le seguenti:
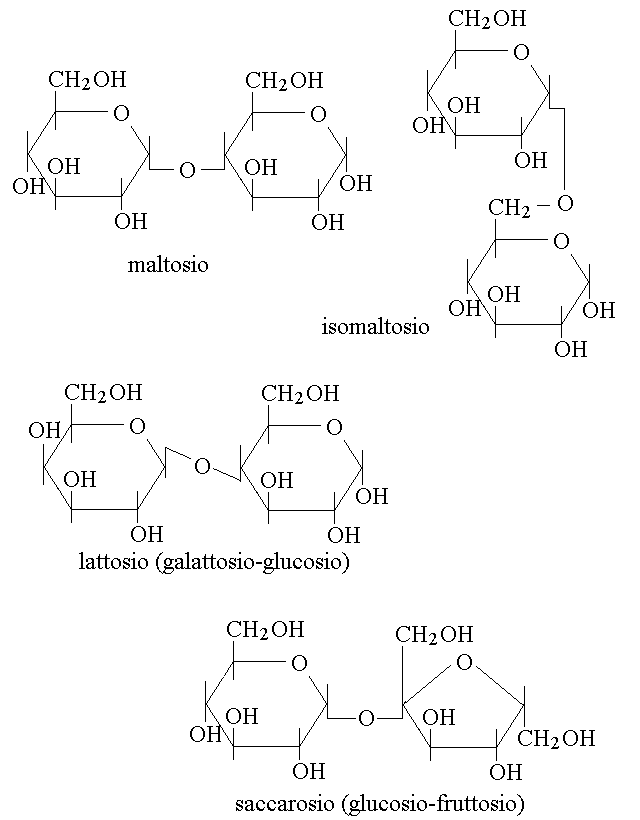
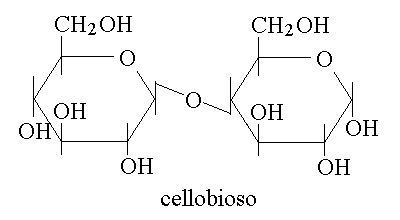
Un esempio di disaccaride che l'uomo non e' in grado di digerire e che quindi dal punto di vista alimentare e' fibra (cioe' materiale inerte, che finisce nelle feci) e' il cellobioso, unita' strutturale della cellulosa. Il cellobioso ci illustra l'importanza dell'isomeria ottica nella biologia: infatti e' un dimero di glucosio e sarebbe identico al maltosio se non fosse per il legame β 1-4 glicosidico (anziche' α 1-4); inoltre e' identico al lattosio (galattosio β 1-4 glucosio), salvo per la configurazione stereochimica del C4 del primo monomero. E' soltanto l'estrema selettivita' degli enzimi che rende cosi' diversi il lattosio dal cellobioso nel nostro organismo.
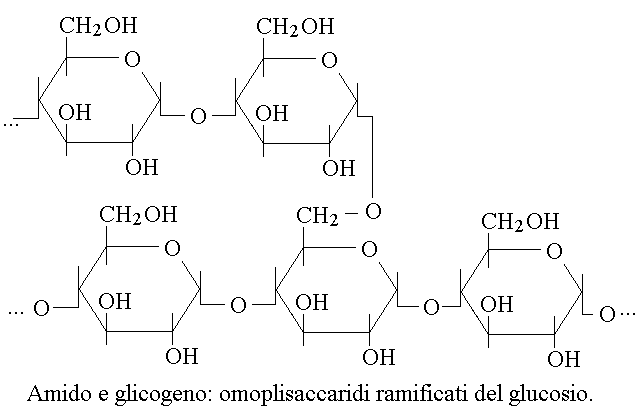
OMOPOLISACCARIDI. I polisaccaridi possono essere costituiti da monomeri identici tra loro (in genere glucosio); si chiamano allora omopolisaccaridi ed hanno la funzione di sostegno strutturale (la cellulosa delle piante, polimero lineare di glucosio con legami β 1-4 glicosidici) o di riserva energetica (l'amido delle piante ed il glicogeno degli animali, polimeri ramificati di glucosio con legami α 1-4 e α 1-6 glicosidici; l'amido comprende molte migliaia di molecole di glucosio, il glicogeno molti milioni):
MUCOPOLISACCARIDI. I mucopolisaccaridi sono omopolimeri di disaccaridi; di conseguenza nella loro struttura due monosaccaridi si alternano in modo regolare. Molto spesso i monosaccaridi che costituiscono i mucopolisaccaridi sono monosaccaridi modificati, che non hanno la formula canonica CnH2nOn. Assolvono importanti funzioni strutturali nella matrice inorganica dei vari tipi di tessuto connettivo. Un esempio importante e' dato dall'acido ialuronico, il polimero di un disaccaride costituito da N-acetil glucosamina e acido glucuronico:
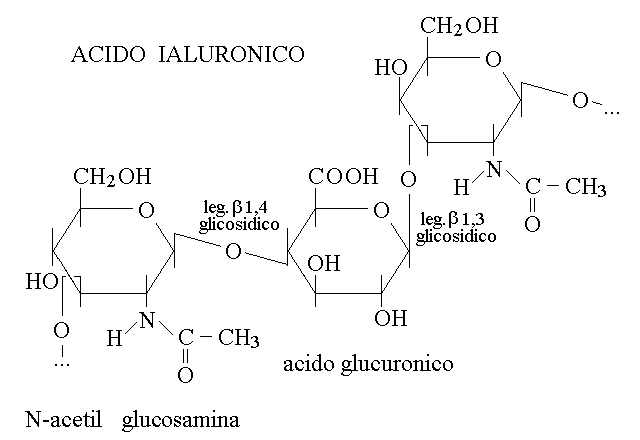
ETEROPOLISACCARIDI. Gli eteropolisaccaridi sono piccoli polisaccaridi nei quali i monomeri si susseguono con sequenza libera. La biosintesi e' complessa (e' necessario un enzima diverso per ogni singolo monomero) ed hanno spesso funzioni di rivestimento cellulare e di riconoscimento. Ne e' un esempio il polisaccaride dei gruppi sanguigni AB0, composto da una struttura polisaccaridica di base (la sostanza H) sulla quale possono poi essere attaccati altri monosaccaridi. L'antigene AB0 e' presente sulla membrana cellulare, ed in particolare sulla membrana dei globuli rossi, ed e' responsabile delle reazioni di incompatibilita' alla trasfusione del sangue.

I lipidi (chiamati anche grassi) sono composti di origine biologica, eterogenei dal punto di vista chimico, che condividono la caratteristica di essere scarsamente solubili in acqua. Di conseguenza, posti in soluzione acquosa, tendono a separarsi e formare una fase propria come accade ad esempio se si mescolano acqua e olio.
I lipidi possono essere raggruppati in classi chimicamente piu' omogenee:
1) Cere (esteri di acidi carbossilici a lunga catena idrocarburica con alcoli a lunga catena idrocarburica; spesso l'acido e l'alcol hanno lo stesso numero di acidi di carbonio)
2) Gliceridi e fosfogliceridi (esteri del glicerolo)
3) Colesterolo e suoi derivati
4) Derivati della sfingosina, che includono anche i glicosidi e i cerebrosidi ("glicolipidi").
Gli acidi grassi sono acidi carbossilici di alcani, alcheni o polieni con 10-20 atomi di carbonio. In genere il numero totale degli atomi di carbonio e' pari perche' la biosintesi di questi composti e' effettuata unendo tra loro molecole a due atomi di carbonio. Esempi di acidi grassi sono:
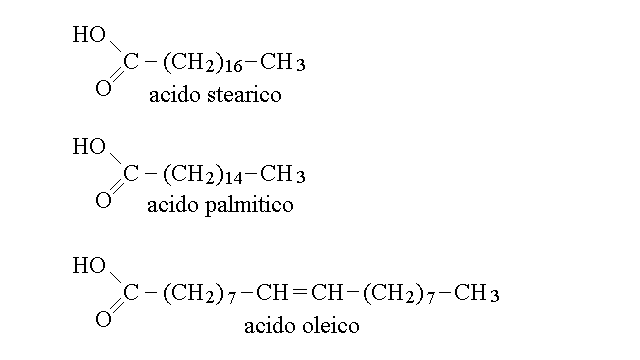
Gli acidi grassi si comportano in acqua come acidi deboli poco solubili, e dissociano reversibilmente come dall'esempio seguente, con valori di Ka prossimi a 10-5 M:
CH3-(CH2)7-CH=CH-(CH2)7-COOH + H2O <==> CH3-(CH2)7-CH=CH-(CH2)7-COO- + H3O+
I sali degli acidi grassi (in genere ottenuti mediante titolazione con basi forti o idrolisi basica dei trigliceridi) sono chiamati saponi. Ad esempio la formula del sapone palmitato di sodio e': CH3-(CH2)14-COONa.
Essendo elettroliti forti (come qualunque altro sale) i saponi in acqua sono dissociati negli ioni costituenti (e danno una modesta idrolisi basica). Una caratteristica dei saponi e' la capacita' di formare in acqua degli aggregati sferici chiamati micelle, nei quali la parte idrofobica della molecola e' sequestrata all'interno della sferula mentre verso l'esterno viene rivolto il gruppo carbossilico ionizzato, polare e capace di interagire con l'acqua.
I gliceridi sono esteri del glicerolo (propantriolo; e' il prodotto di riduzione del diidrossiacetone) con acidi grassi. Se una molecola di glicerolo forma un legame estere con un solo acido grasso il prodotto si chiama monogliceride; se forma due legami estere con due acidi grassi si ha un digliceride; ed infine se forma tre legami estere con tre acidi grassi si ha un trigliceride:
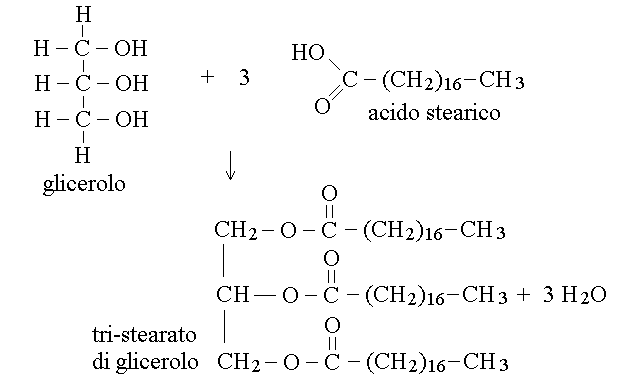
I trigliceridi sono molto comuni nel nostro organismo (la gran parte delle nostre riserve energetiche, contenute nel tessuto adiposo e' costituita da trigliceridi) e negli alimenti (sono prevalentemente costituiti da trigliceridi l'olio, il burro e i grassi animali). I digliceridi e i monogliceridi sono intermedi nella biosintesi e nella degradazione (digestione) dei trigliceridi, ma non sono molto rappresentati nel nostro organismo.
Quando gli acidi grassi dei trigliceridi sono saturi, le molecole si impaccano strettamente tra loro e la sostanza e' solida a temperatura ambiente (ad es. il burro); quando invece una parte consistente degli acidi grassi e' costituita da molecole insature o poliinsature, la sostanza e' liquida a temperatura ambiente (ad es. olio).
I fosfogliceridi sono derivati dell'acido fosfatidico un derivato del glicerolo nel quale i primi due gruppi ossidrilici dell'alcol sono esterificati con due acidi grassi, e il terzo con acido fosforico. I fosfogliceridi presentano un secondo alcol a sua volta esterificato con il residuo fosforico dell'acido fosfatidico; ne e' un esempio la fosfatidil-etanolamina:
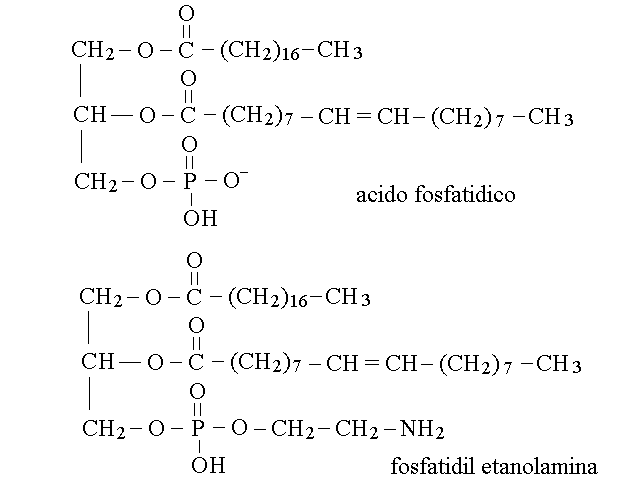
L'idrolisi dei fosfogliceridi restituisce quattro componenti: glicerolo, acidi grassi, acido fosforico e il "quarto componente" (che sopra e' stato chiamato secondo alcol). I principali quarti componenti dei fosfogliceridi biologici sono tre aminoalcoli (2-etanolamina, serina e colina) e l'inositolo.
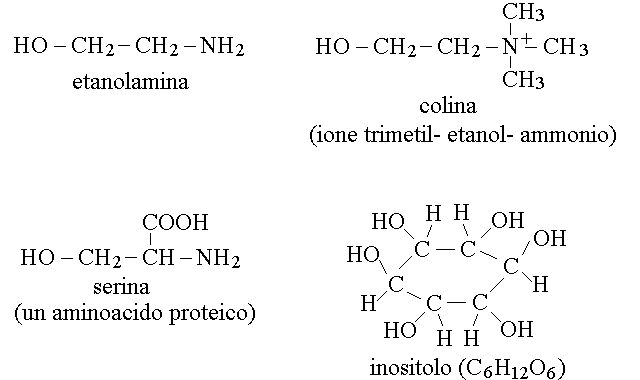
MEMBRANE LIPIDICHE
Le cellule sono rivestite da membrane costituite da un doppio strato di fosfolipidi, nel quale sono immerse proteine. Il principale tipo di fosfolipidi delle membrane biologiche e' rappresentato dai fosfogliceridi, contenenti sia acidi grassi saturi che insaturi, e tutti i tipi di quarti componenti. Il motivo per il quale i fosfolipidi formano le membrane a doppio strato e' connesso con il fatto che essi presentano una "testa" polare che interagisce con l'acqua (il gruppo fosfato - quarto componente) e due "code" apolari (le catene idrocarburiche degli acidi grassi) che invece interagiscono tra loro:
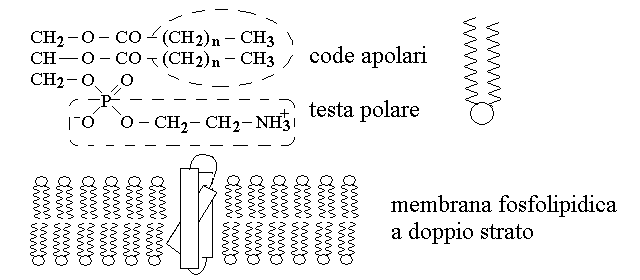
Il colesterolo ed i suoi derivati sono globalmente chiamati steroidi; tutti condividono una struttura comune. Nel nostro organismo il colesterolo e' sintetizzato per primo e ciascuno dei suoi derivati e' sintetizzato a partire da lui. Il colesterolo e' un alcol policiclico non aromatico la cui struttura deriva da una molecola, non presente nell'organismo, chiamata ciclopentano-peridrofenantrene:
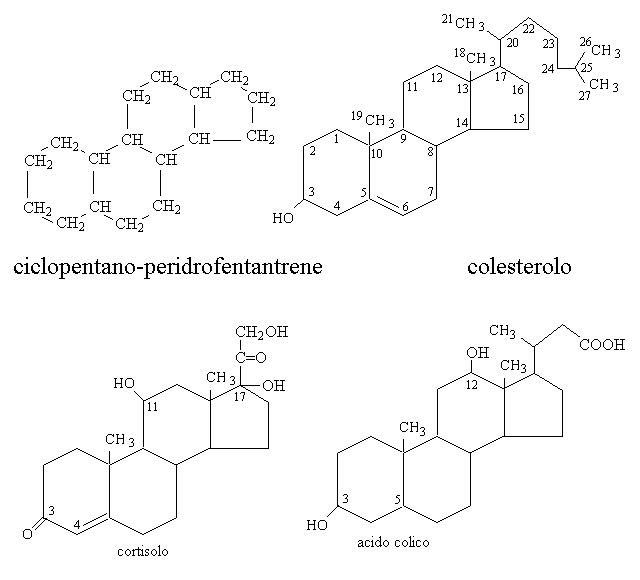
Il colesterolo, oltre ad essere il precursore di tutti gli steroidi, e' presente come tale o nella forma dei suoi esteri nelle membrane cellulari insieme ai fosfolipidi, e' conservato nel tessuto adiposo ed e' trasportato agli altri tessuti dalle lipoproteine del sangue.
I principali derivati del colesterolo appartengono a due classi molto diverse tra loro per struttura e funzioni:
1) Gli ormoni steroidei, a loro volta classificati come glicocorticoidi (cortisolo, cortisone, etc.); mineralcorticoidi (aldosterone); e ormoni sessuali (maschili: testosterone, androstenedione, etc.; femminili: estrogeni, progesterone). Tutti gli ormoni steroidei sono prodotti dalla corticale del surrene, ma nel caso degli steroidi sessuali la sede principale di produzione e' rappresentata dalle gonadi (ovaio e testicolo).
2) I sali o acidi biliari, prodotti dal fegato (ad es. l'acido colico), che hanno la funzione di emulsionare e rendere digeribili i lipidi introdotti con l'alimentazione.
La sfingosina e' un aminoalcol a 18 atomi di carbonio. Il prodotto della reazione tra la sfingosina e un acido grasso e' chiamato ceramide (il nome deriva dal legame carboamidico che unisce i due composti). La ceramide assomiglia per struttura ad un digliceride. Ne' la sfingosina ne' la ceramide si trovano da soli nel nostro organismo; pero' la ceramide (come i digliceridi) puo' coniugarsi con un acido fosforico e quest'ultimo con un quarto componente; il prodotto finale e' un fosfolipide diverso dai fosfogliceridi, chiamato sfingomielina. Le formule ed i confronti tra le strutture nominate sono cosi' rappresentati:
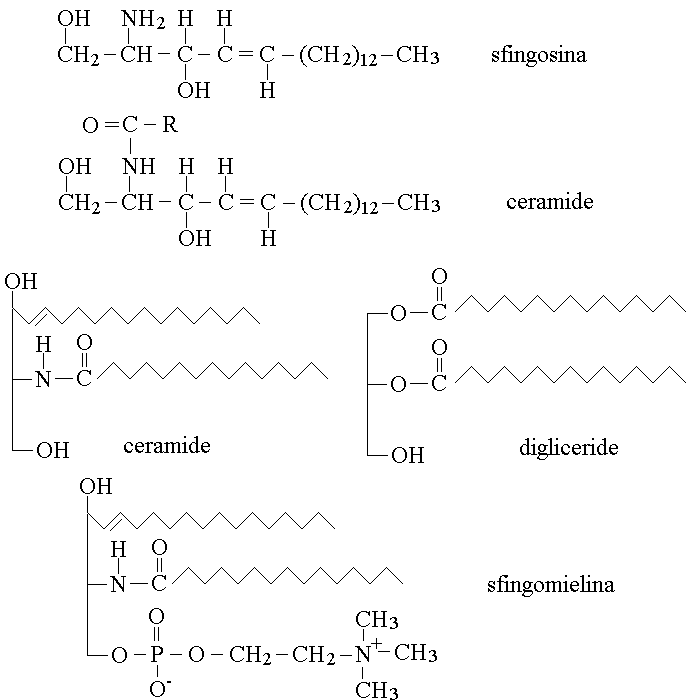
La sfingomielina partecipa alla costituzione delle membrane cellulari comportandosi esattamente come un fosfogliceride, ed e' un componente importante di alcune membrane molto particolari come quelle dei neuroni e della glia (guaine mieliniche).
Un altro tipo di derivati della ceramide ha importanza in biologia e medicina: i glicosfingolipidi (gangliosidi e cerebrosidi). In questi lipidi molto particolari, che partecipano anch'essi alla costituzione delle membrane dei neuroni e della glia, il gruppo semiacetalico di uno zucchero (o quello terminale di un piccolo polisaccaride) forma un legame di tipo acetalico (glicosidico) con il gruppo alcolico libero della ceramide:
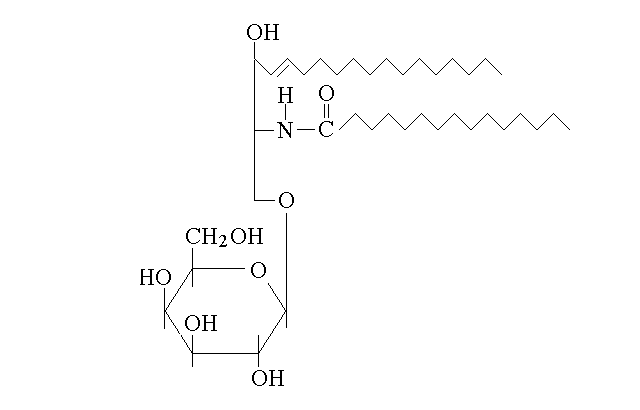
Gli aminoacidi presentano un gruppo carbossilico, un gruppo aminico e un residuo legati ad un carbonio centrale, asimmetrico, chiamato Cα. Sono composti molto importanti, che svolgono varie funzioni nell'organismo, la principale delle quali e' l'essere i monomeri delle proteine, eteropolimeri lineari orientati molto importanti in biologia. Gli aminoacidi che costituiscono le proteine (aminoacidi "proteici") sono tutti stereoisomeri L sul Cα e sono 20, differenti per il residuo R.
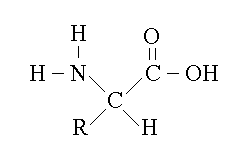
I residui R dei 20 aminoacidi proteici sono:
1) alifatici:
glicina (Gly, G): R = H
alanina (Ala, A): R = CH3
valina (Val, V): R = CH(CH3)2
leucina (Leu, L): R = CH2-CH(CH3)2
isoleucina (Ile, I): R = CH(CH3)-CH2-CH3
2) polari:
serina (Ser, S): CH2OH
cisteina (Cys, C): CH2SH
treonina (Thr, T): CHOH-CH3
metionina (Met, M): CH2-CH2-S-CH3
3) la prolina e' l'unico iminoacido e viene riportato per intero anziche' col solo residuo R (vedi figura)
4) aromatici:
fenilalanina (Phe, F; vedi figura)
tirosina (Tyr, Y; vedi figura)
triptofano (Trp, W; vedi figura)
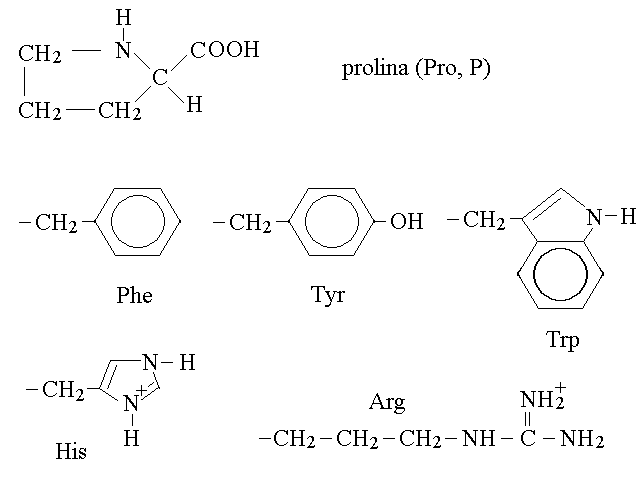
5) basici:
istidina (His, H; vedi figura)
lisina (Lys, K): (CH2)4 - NH2
arginina (Arg, R; vedi figura)
6) acidi (dicarbossilici):
acido aspartico (Asp, D): CH2-COOH
acido glutamico (Glu, E): CH2-CH2-COOH
7) amidici:
asparagina (Asn, N): CH2-CONH2
glutamina (Gln, Q): CH2-CH2-CONH2
TITOLAZIONE DEGLI AMINOACIDI. Il gruppo α-aminico di ogni aminoacido si titola come una base debole ed il gruppo α-carbossilico come un acido debole; possono inoltre essere presenti eventuali altri gruppi titolabili nel residuo R (aminacidi basici e acidi; tirosina). Per effettuare la titolazione occorre partire da una specie completamente acidificata, come ad esempio il sale cloruro della forma aminica protonata: Cl- NH3+-CαHR-COOH e aggiungere piccole aliquote di base a concentrazione nota:

REAZIONI DEGLI AMINOACIDI.
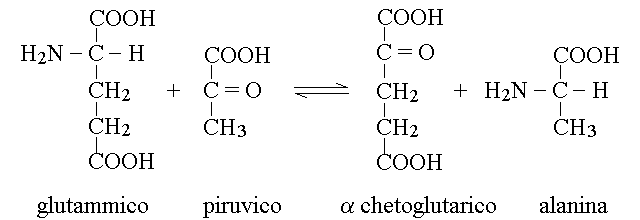
1) Transaminazione con un α-chetoacido (scambio dei gruppi aminico e chetonico). E' la reazione catalizzata dagli enzimi chiamati transaminasi, normalmente contenuti all'interno delle cellule (specialmente del fegato; in corso di malattie di quest'organo la morte delle cellule rilascia le transaminasi nel sangue, dove vengono dosate). Ad esempio la Glutamico-Piruvico Transaminasi (GPT, ALT) catalizza la seguente reazione reversibile:
2) Decarbossilazione: restituisce anidride carbonica e l'amina corrispondente all'aminoacido; e' catalizzata dalle decarbossilasi. Alcune delle amine ottenute in questa reazione hanno attivita' di mediatori o ormoni. Ad esempio:
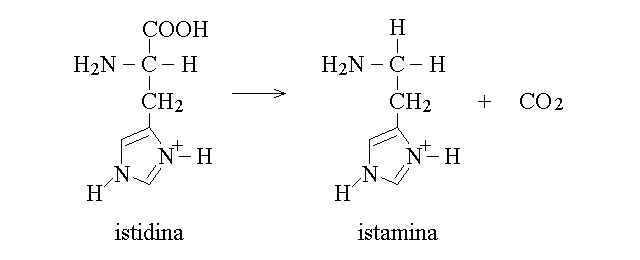
AMINOACIDI NON PROTEICI. Alcuni amnoacidi non presenti nelle proteine hanno grande rilievo in biologia e in medicina. Ad esempio la D-alanina e' un componente del peptidoglicano che costituisce il rivestimento di molti batteri, mentre la L-ornigtina e' un intermedio metabolico della biosintesi dell'urea.
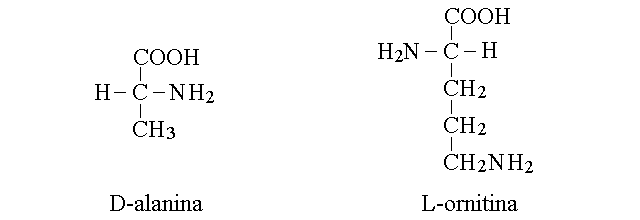
I polimeri degli aminoacidi si formano grazie al legame peptidico, un caso particolare del legame carboamidico (cosi' chiamato perche' simile al gruppo amidico):
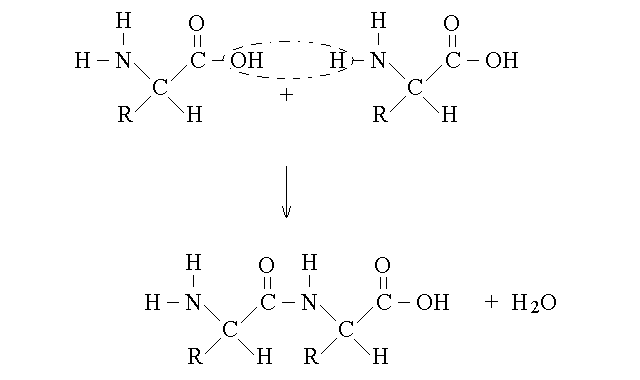
Il legame peptidico si instaura tra il carbonio del gruppo α carbossilico del primo aminoacido e l'azoto del gruppo α aminico del secondo aminoacido, con eliminazione di una molecola d'acqua. Per capire bene la struttura e le proprieta' di questo legame importantissimo in biologia, occorre fare le seguenti osservazioni:
1) il carbonio e l'azoto coinvolti nel legame peptidico presentano entrambi l'ibridazione sp2 e la geometria trigonale planare.
2) Come conseguenza del precedente punto 1, il carbonio, l'azoto, gli atomi legati al carbonio (Cα e O) e quelli legati all'azoto (Cα e H) giacciono tutti sullo stesso piano.
3) C'e' delocalizzazione del doppio legame tra l'ossigeno, il carbonio e l'azoto; questo conferisce al legame peptidico un parziale carattere di doppio legame (come del resto avviene nelle amidi):
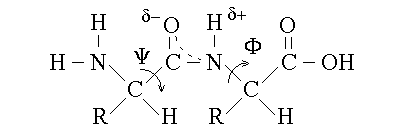
4) A causa della parziale natura di doppio legame del legame peptidico, non e' ammessa la rotazione del CO e dell'NH ed il legame peptidico presenta gli isomeri geometrici cis e trans (quest'ultimo e' preferito per il minore ingombro sterico che deriva dall'allontanare tra loro il Cα legato al CO e il Cα legato all'NH).
5) E' permessa la rotazione del Cα rispetto al CO e del Cα rispetto all'NH, con gli angoli di legame denominati rispettivamente psi e fi.
POLIPEPTIDI E PROTEINE. I polipeptidi sono i polimeri degli aminoacidi. Sono eteropolimeri, perche' la sequenza dei residui e' libera; sono lineari (non ramificati) ed orientati, perche' hanno una estremita' con il gruppo aminico libero ed una con il gruppo carbossilico libero:
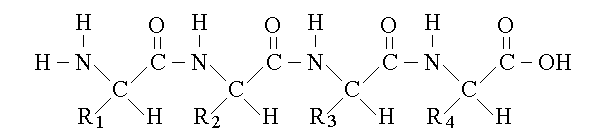
Le proteine sono polipeptidi di grandi dimensioni (da 100 ad oltre 1000 residui aminoacidici) con peso molecolare superiore a 10.000 UMA. La loro sequenza aminoacidica e' determinata dai geni contenuti nel DNA della cellula.
STRUTTURA DELLE PROTEINE. Le proteine presentano una struttura complessa, descritta secondo quattro livelli di organizzazione ordinati gerarchicamente:
1) la struttura primaria e' data dalla sequenza degli aminoacidi, a partire dall'estremita' amino-terminale della catena polipeptidica. E' sostanzialmente un elenco di aminoacidi come ad es. NH2-Val-...-Arg-COOH.
2) La struttura secondaria e' dovuta al ripiegamento su se stessa della catena polipeptidica causato dallo stabilirsi di legami idrogeno tra i gruppi NH e CO dei legami peptidici. Puo' essere periodica, nelle forme a spirale (detta α-elica) e del foglietto β (fatto di segmenti lineari contrapposti), oppure non periodica (ripiegamento casuale).
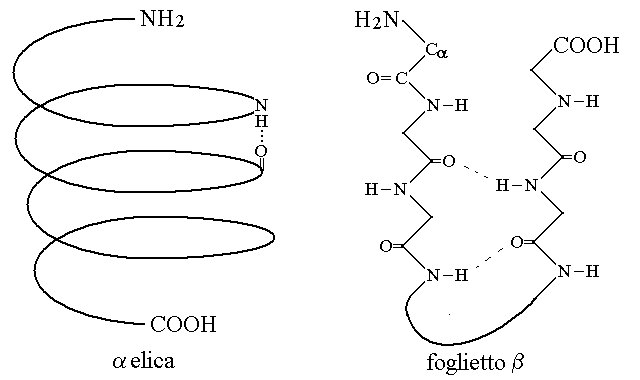
L'α-elica e' una spirale che presenta circa 3,4 residui aminoacidici per giro; il foglietto β si forma se tratti diversi della catena polipeptidica si dispongono gli uni di fronte agli altri in senso parallelo o antiparallelo (come in figura). In entrambi i casi, le strutture periodiche richiedono angoli di rotazione fi e psi costanti per i tratti della catena polipeptidica interessati. Le strutture periodiche sono entro certi limiti indipendenti dalla sequenza aminacidica perche' tutti gli aminoacidi possiedono i gruppi CO e NH necessari per formarle. Esistono pero' eccezioni perche' alcuni aminoacidi o sequenze di aminoacidi non formano i legami fi e psi necessari (ad es. la prolina interrompe le α-eliche).
3) la struttura terziaria e' data dal ripiegarsi su se stessi di segmenti a struttura secondaria periodica e da alla macromolecola la sua forma che puo' essere fibrosa (allungata) o globulare (approssimativamente sferica). I legami chimici che mantengono le strutture terziari sono a carico del residuo R degli aminoacidi e pertanto le strutture terziarie, al contrario delle secondarie sono fortemente dipendenti dalle sequenze aminoacidiche; essi sono: (a) interazioni di Van der Waals tra i residui aminoacidici apolari che si separano spontaneamente dal solvente acquoso rifugiandosi all'interno della macromolecola; (b) i legami idrogeno e i legami ionici tra residui aminoadicici distanti; (c) legami disolfuro tra residui di cisteina:
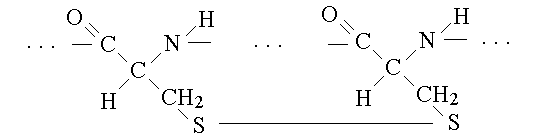
4) la struttura quaternaria e' data dall'eventuale aggregazione di piu' catene polipeptidiche. Alcune proteine sono costituite da una sola catena polipeptidica (ad es. l'albumina del sangue), altre da piu' di una legate insieme dagli stessi legami responsabili del mantenimento della struttura terziaria (ad es. le immunoglobuline).
DENATURAZIONE DELLE PROTEINE. Si chiama nativa la struttura secondaria e terziaria (e quaternaria se c'e') normalmente presente nelle condizioni fisiologiche e capace delle funzioni biologiche caratteristiche della proteina in questione. Nella gran parte dei casi, le proteine vengono preparate dai tessuti biologici nella loro struttura nativa. Tutte le proteine, pero', possono essere poste in condizioni sperimentali nelle quali la struttura terziaria, e in alcuni casi anche secondaria, vengono perdute. Questo processo si chiama denaturazione. In molte proteine la denaturazione e' un processo reversibile e se la proteina denaturata viene posta in condizioni sperimentali adeguate essa spontaneamente riacquista la sua struttura nativa (rinaturazione). Gli esperimenti di denaturazione-rinaturazione dimostrano che la struttura secondaria e terziaria delle proteine sono interamente determinate dalla struttura primaria e suggeriscono che la configurazione nativa corrisponda ad un minimo termodinamico dell'energia delle interazioni degli aminoacidi tra loro e col solvente.
Le procedure comunemente impiegate per denaturare le proteine sono: il riscaldamento, la variazione del pH, l'uso di solventi organici o l'aggiunta di soluti perturbatori della struttura dell'acqua (urea, guanidina). In genere la differenza energetica tra la configurazione nativa e le configurazioni denaturate (che sono tra loro isomeri conformazionali e geometrici) e' piccola e corrisponde a poche kcal/mole
Gli acidi nucleici (desossiribonucleico, DNA e ribonucleico, RNA), che conservano e trasmettono l'informazione genetica, sono eteropolimeri lineari orientati di nucleotidi.
NUCLEOTIDI. I nucleotidi sono molecole complesse costituite da uno zucchero (il ribosio oppure il 2-desossiribosio), una base azotata deivata dalla purina oppure dalla pirimidina, e una molecola di acido fosforico:
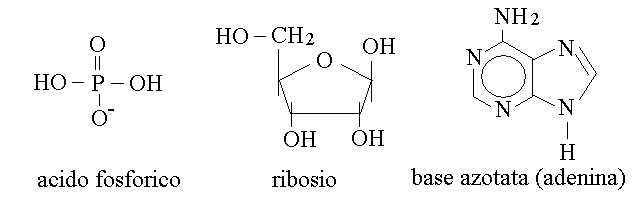
RIBOSIO E DESOSSIRIBOSIO. Il ribosio e' un aldopentoso che in soluzione forma una struttura ciclica semiacetalica a cinque atomi di tipo furanosico; il 2-desossiribosio e' un derivato del ribosio.
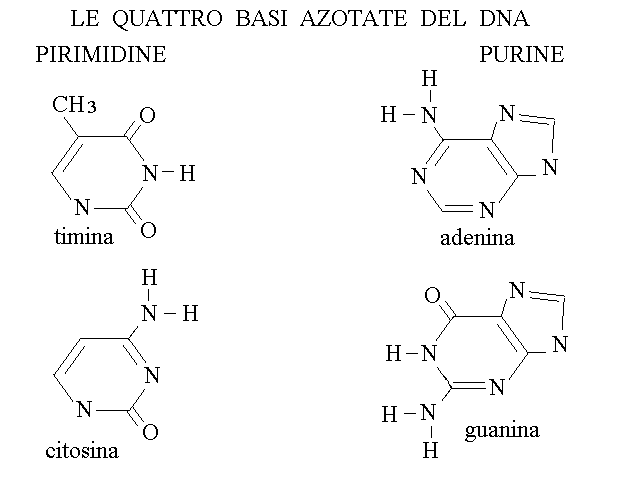
LE BASI AZOTATE. Le basi azotate del DNA e dello RNA sono eterociclici a carattere aromatico, e dal punto di vista chimico si possono considerare derivati della purina o della pirimidina (si vedano le formule di questi composti nella lezione sulla chimica organica). E' importante sottolineare che dal punto di vista biochimico, la biosintesi delle basi azotate non passa attraverso la purina e la pirimidina; la classificazione chimica non ha quindi rapporto con l'origine biologica di questi composti.
Nel DNA si trovano quattro basi azotate: due purine (adenina, A, e guanina, G) e due pirimidine (timina, T, e citosina, C). Nello RNA si trovano quattro basi azotate delle quali tre sono identiche a quelle del DNA (adenina, guanina e citosina) mentre la quarta e' leggermente diversa (uracile, U, al posto della timina; la differenza tra queste due e' la sostituzione di un idrogeno dell'uracile con un gruppo metilico nella timina che risulta quindi essere metil-uracile).
STRUTTURA DEI NUCLEOTIDI. Le tre molecole che costituiscono il nucleotide si legano tra loro in questo modo: l'acido fosforico forma un legame di tipo estere con l'ossidrile in posizione 5 del ribosio o del desossiribosio; la base azotata forma un legame di tipo N-glicosidico con il carbonio semiacetalico dello zucchero:
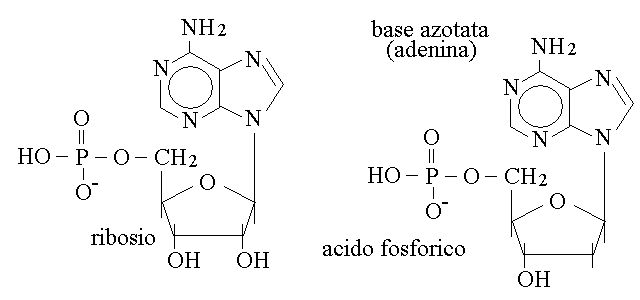
Come si vede in figura, la differenza tra il ribonucleotide (a sinistra) e il desossiribonucleotide (a destra) e' limitata alla presenza o assenza dell'ossidrile in posizione 2 sullo zucchero, che non partecipa al legame con l'acido fosforico ne' con la base azotata.
Per non confondere nella descrizione della molecola gli atomi di carbonio della base azotata con quelli dello zucchero si adotta la seguente convenzione: con la notazione C1,C2, etc. ci si riferisce alla base azotata mentre con C1',C2', etc. ci si riferisce allo zucchero. E' quindi corretto dire che l'acido fosforico si lega alla posizione C5' dello zucchero e la base alla C1' (leggi C5 primo, C1 primo).
LEGAME FOSFODIESTERE. Il polimero dei nucleotidi si forma mediante lo stabilirsi di un legame fosfodiestere tra l'acido fosforico legato ad un nucleotide e l'ossidrile in posizione C3' del nucleotide successivo (e di nuovo non viene utilizzata la posizione C2': questo significa che il legame e' analogo nel DNA e nello RNA):
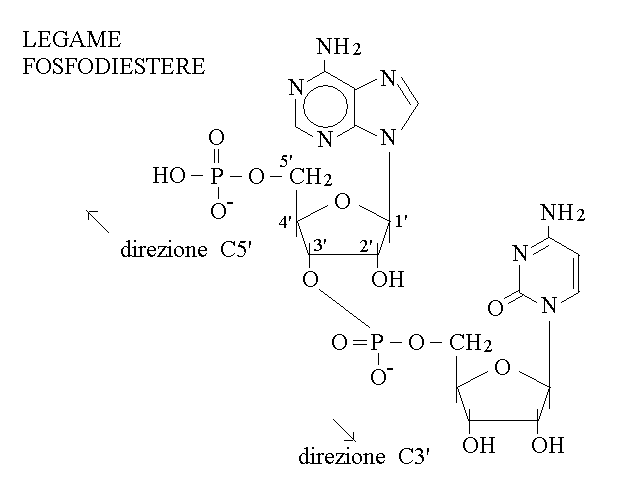
Il polimero di nucleotidi (spesso chiamato un "filamento") presenta le seguenti caratteristiche:
1) ha uno scheletro lineare formato dalla sequenza ribosio-fosfato-ribosio, che non ammette ramificazioni;
2) e' orientato (ha una estremita' col C5' libero ed una col C3' libero);
3) e' un eteropolimero (le basi azotate non parecipano allo scheletro e la loro sequenza e' libera).
ACCOPPIAMENTO DELLE BASI AZOTATE. Le basi azotate possono accoppiarsi tra loro mediante legami idrogeno in due sole coppie: A con T (e la sua inversa, T con A; nello RNA A con U e U con A) e G con C (e la sua inversa, C con G). La limitazione degli accoppiamenti possibili e' dovuta ai seguenti fattori:
1) quando i polimeri si appaiano per lunghi tratti le coppie devono essere purina-pirimidina: la coppia purina-purina e' troppo grande, la coppia pirimidina-pirimidina troppo piccola rispetto alla siatnza tra i due polimeri appaiati.
2) La coppia AT forma due legami idrogeno e la coppia GC ne forma tre.
3) La polarita' dei legami idrogeno in posizione corrispondente nelle due coppie e' inversa. Questo si osserva molto bene in figura: ad esempio T presenta un gruppo accettore dell'idrogeno, cioe' un CO, in corrispondenza di un gruppo donatore su A, cioe' NH2; l'altra purina (G) non potrebbe formare questo legame perche' nella posizione corrispondente G presenta un gruppo accettore di idrogeno (CO). Ragionamenti analoghi si possono fare per tutti gli altri legami idrogeno.
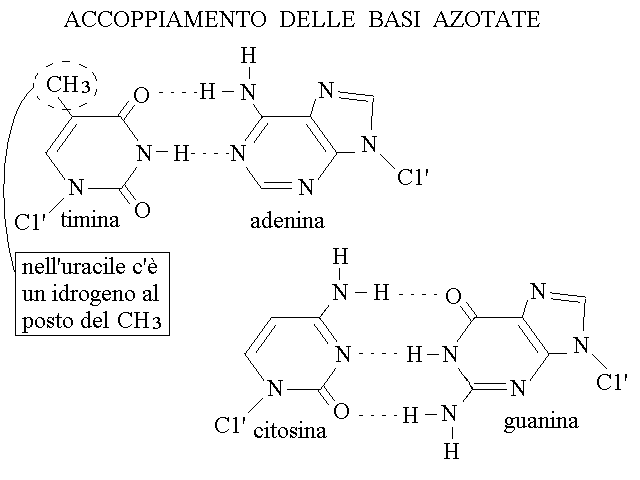
4) la coppia AU nello RNA e' sostanzialmente analoga alla coppia AT nel DNA perche' la sola differeza tra U e T (assenza o presenza di un gruppo metilico) occorre in una posizione che non interferisce con i legami idrogeno responsabili dell'appaiamento.
STRUTTURA E REPLICAZIONE DEL DNA. Il DNA si trova nei cromosomi delle cellule eucariote o nel citoplasma delle cellule procariote ed ha la struttura di due polimeri tra loro appaiati per via dei legami idrogeno tra le rispettive basi azotate. I due polimeri o filamenti sono allineati in senso antiparallelo (cioe' la polarita' C3'-C5' del secondo e' inversa a quella del primo). Questa disposizione consente a ciascuno dei due filamenti di potersi comportare come un "stampo per la biosintesi dell'altro: cioe' la sequenza nucleotidica di ciascuno e' anequivocamente indicata da quella, complementare e antiparallela, dell'altro:
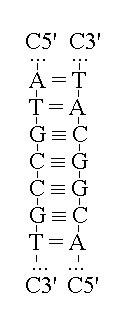
La duplicazione del DNA richiede la separazione dei due filamenti e la polimerizzazione di nucleotidi trifosfati, con formazione del legame fosfodiestere ed eliminazione di una molecola di acido pirofosforico (H4P2O7) per ogni legame formato. La reazione e' catalizzata dall'enziam DNA polimerasi, che aggiunge all'estremita' C3' della catena polinucleotidica neoformata un nucleotide C5' trifosfato; pertanto la biosintesi del DNA procede nella direzione C3' -> C5'. La DNA polimerasi non sa in quale sequenza devono essere disposti i nucleotidi: prende questa informazione da uno dei due filamenti, utilizzato come "stampo", e ne sintetizza uno complementare e antiparallelo. La DNA polimerasi umana e' un enzima molto preciso, che commette meno di un errore per ogni milione di nucleotidi aggiunti. L'errore della DNA polimerasi costituisce una mutazione.
Esiste inoltre un altro enzima, la RNA polimerasi, che forma catene polinucleotidiche di RNA utilizzando come stampo un filamento di DNA. Questo processo si chiama trascrizione e consente di esportare l'informazione genetica al di fuori del nucleo per la sintesi proteica.
Perche' gli acidi nucleici sono le molecole prescelte dalla selezione naturale per mantenere e trasmettere l'informazione genetica? Gli acidi nucleici possiedono duee proprieta' molto peculiari e adatte per questi scopi:
1) sono eteropolimeri lineari a sequenza libera. Un omopolimero non potrebbe portare nessuna informazione.
2) L'accoppiamento delle basi azotate e' fondamentale per la duplicazione del DNA e quindi per la replicazione cellulare; e' molto importante quindi che gli accoppiamenti esistano e che siano molto rigorosi (e' un vantaggio che le coppie siano soltanto due perche' questo riduce il rischio di errori della DNA polimerasi).
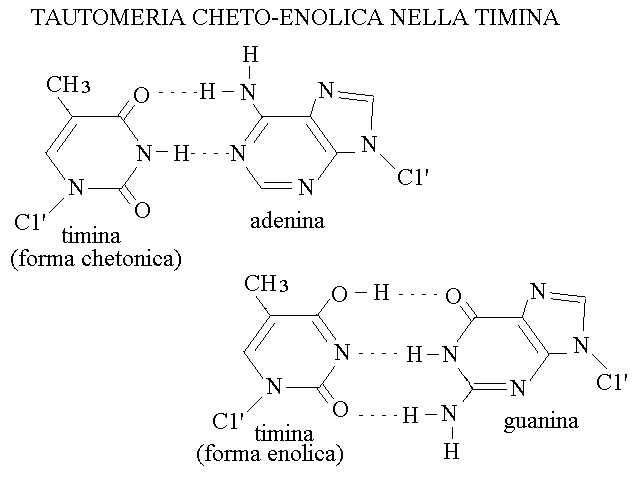
TAUTOMERIA CHETO-ENOLICA DELLE BASI AZOTATE. Alcune delle basi azotate dello RNA o del DNA possono andare incontro a fenomeni di tautomeria cheto-enolica e presentarsi quindi, occasionalmente, nella meno comune forma enolica. Questo fenomeno, che e' una reazione chimica e avviene per ciascuna molecola indipendendemente da ogni altra, e' particolarmente rilevante nel caso del DNA perche' se interviene nel corso della sua replicazione puo' alterare gli accoppiamenti delle basi ed essere causa di mutazione. Il caso piu' evidente e' quello della timina, il cui tautomero chetonico si accoppia con l'adenina, mentre quello enolico si accoppia con la guanina:
Torna a: didattica; pagina iniziale.