PRIMA FACOLTA' DI MEDICINA E CHIRURGIA - CLUPS DIETISTA; INFERMIERE; TECNICO DI LABORATORIO
SAPIENZA UNIVERSITA' DI ROMA
In questa parte del Corso vengono trattate le principali reazioni chimiche delle cellule viventi. In primo luogo vengono definite le proprieta' funzionali ed il ruolo degli ENZIMI, le proteine dotate di attivita' catalitica che accelerano le reazioni chimiche necessarie alla vita. In assenza degli enzimi nessuna reazione chimica potrebbe avvenire su scale di tempo compatibili con i fenomeni biologici. In secondo luogo vengono definite le reazioni e le funzioni degli ACIDI NUCLEICI: la duplicazione del DNA e la sintesi proteica; vengono inoltre sviluppati alcuni concetti relativi all'organizzazione funzionale del DNA nei cromosomi. Ovviamente tutti i processi descritti sono sequenze di reazioni catalizzate da enzimi. Infine viene trattato il METABOLISMO propriamente detto, cioe' l'insieme delle reazioni chimiche (tutte catalizzate da enzimi) che servono alla produzione di energia (catabolismo) o alla biosintesi di molecole necessarie al ricambio dei componenti cellulari (anabolismo). Non tutti i metabolismi riportati in questo file vengono spiegati in tutti i corsi e in linea di massima appartengono al programma d'esame i soli metabolismi effettivamente spiegati durante il Corso.
GLI ENZIMI SONO PROTEINE che hanno la funzione di combinarsi reversibilmente con un'altra molecola detta SUBSTRATO, distorcerne la struttura e accelerarne le trasformazioni: OGNI ENZIMA ACCELERA (CATALIZZA) UNA SPECIFICA REAZIONE A CARICO DI UNO SPECIFICO SUBSTRATO. Ad esempio la conversione dell'anidride carbonica in acido carbonico e' lenta a temperatura ambiente, ma diventa molto rapida se e' presente uno specifico enzima, chiamato anidrasi carbonica, che catalizza la reazione:
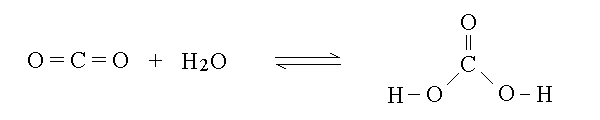
Praticamente ogni reazione che avviene all'interno dell'organismo, sia in sede intracellulare che extracellulare e' catalizzata (=accelerata) da un enzima. Il ruolo degli enzimi e' fondamentale per tre ragioni:
1) in loro assenza le reazioni chimiche sarebbero troppo lente per le necessita' dell'organismo.
2) In loro assenza le reazioni sarebbero aspecifiche: infatti ogni composto biochimico puo' trasformarsi in molte maniere diverse, la maggior parte delle quali risulterebbero inutili o dannose per l'organismo. Se l'enzima e' presente, la reazione da questo catalizzata diventa molto piu' rapida e quindi prevale sulle altre possibili reazioni (non catalizzate) dello stesso substrato.
3) Gli enzimi possono accoppiare tra loro due reazioni chimiche diverse, in modo tale che la reazione risultante sia energeticamente favorevole; questo permette di far avvenire trasformazioni che sarebbero altrimenti impossibili.
Un esempio di come gli enzimi possono accoppiare tra loro reazioni diverse, in modo tale che la reazione risultante sia energeticamente favorevole e' dato dalla sintesi del glicogeno. La reazione di polimerizzazione del glicogeno aggiunge una molecola di glucosio ad una del suo polimero glicogeno ed e' energeticamente sfavorevole; non avverrebbe mai in modo spontaneo. Quattro enzimi accoppiano la polimerizzazione alla idrolisi dell'ATP (adenosina trifosfato) e UTP (uridina trifosfato), reazioni energeticamente favorevoli; il risultato complessivo e' energeticamente favorevole:
1) glucosio + ATP --> glucosio-6-fosfato + ADP (enzima: esochinasi)
2) glucosio-6-fosfato --> glucosio-1-fosfato (enzima: fosfoglucomutasi)
3) glucosio-1-fosfato + UTP --> UDP-glucosio + H4P2O7 (enzima: glucosio-1-fosfato uridil transferasi)
4) glucosion + UDP-glucosio --> glucosion+1 + UDP (enzima: glicogeno sintetasi)
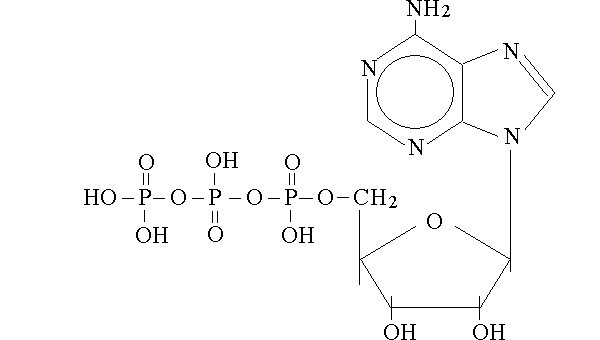
L'ATP (adenosina trifosfato) e' il donatore di energia per molte reazioni biochimiche; la reazione e': ATP + H2O --> ADP + H3PO4. La formula dell'ATP e' la seguente:
In alcuni casi gli enzimi sono proteine semplici, costituite soltanto da una o piu' catene polipeptidiche; in altri casi sono invece PROTEINE CONIUGATE, nelle quali una o piu' catene polipeptidiche sono associate a molecole organiche di natura non aminoacidica o a ioni metallici, essenziali per il processo della catalisi. Per ragioni storiche, le molecole organiche eventualmente coniugate con le catene polipeptidiche degli enzimi sono chiamate COENZIMI; sono esempi di coenzimi il NAD, il FAD, etc.
Il doppio filamento del DNA e' l'unica molecola del nostro organismo che puo' effettivamente essere duplicata; tutte le altre molecole devono essere sintetizzate ex novo. Per chiarire questo concetto occorre porsi uno dei problemi fondamentali della biochimica: quale meccanismo consenta la sintesi degli eteropolimeri. Infatti gli omopolimeri (ad es. il glicogeno) sono sintetizzati da un piccolo numero di enzimi che formano la catena iniziale del polimero e poi aggiungono un monomero per volta alla catena preformata per allungarla. Gli eteropolimeri sono sintetizzati con un meccanismo simile, ma gli enzimi della polimerizzazione non sanno in quale ordine devono essere aggiunti i monomeri, ed hanno bisogno di questa informazione. Nella cellula l'informazione e' contenuta negli acidi nucleici, che svolgono queste due funzioni principali (insieme probabilmente ad altre): contengono l'informazione necessaria per copiare se stessi; e contengono l'informazione necessaria per sintetizzare le proteine, l'altro tipo fondamentale di eteropolimero contenuto nelle nostre cellule.
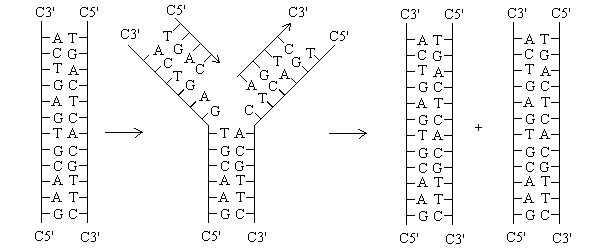
La duplicazione del DNA precede la replicazione cellulare e avviene in questo modo: i due polimeri che costituiscono la doppia elica (filamenti) vengono separati. Questo fenomeno puo' avvenire soltanto in corrispondenza di alcuni punti dell'intera molecola del DNA chiamati "origini" e caratterizzati da specifiche sequenze nucleotidiche ricche in A-T. Le origini sono riconosciute dai complessi multienzimatici necessari per la separazione dei due filamenti. L'origine e' riconosciuta, dopo il disaccoppiamento, da un enzima chiamato PRIMASI che sintetizza un breve tratto di catena poliribonucleotidica complementare a quella della sequenza dei desossiribonucleotidi. La breve sequenza di RNA cosi' sintetizzata e chiamata primer serve da innesco per il processo di duplicazione vero e proprio che e' dovuto all'enzima DNA POLIMERASI, che allinea un nucleotide trifosfato alla volta in modo da appaiarlo a quello del filamento che sta leggendo in quel momento. Lo stesso enzima (DNA polimerasi) catalizza quindi la formazione del legame fosfodiestere tra il nucleotide trifosfato e la catena di DNA nascente. La DNA polimerasi legge il filamento stampo percorrendolo nella direzione 3'->5' e polimerizza il nuovo filamento complementare nella direzione opposta 5'->3': questo e' dovuto al fatto che i due filamenti devono essere antiparalleli. In pratica, un nuovo desossiribonuleotide trifosfato viene aggiunto all'estremita' 3' della catena nascente e il legame fosfodiestere viene formato con eliminazione di una molecola di acido pirofosforico (H4P2O7). Questo processo fa si che ogni filamento contenga l'informazione necessaria a sintetizzare il suo complementare e quando la duplicazone e' completata la cellula possiede due doppie eliche identiche, ciascuna delle quali contiene un filamento vecchio ed uno neoformato (replicazione "semiconservativa"). Le cellule eucariotiche possiedono molte doppie eliche di DNA, diverse tra loro (i cromosomi) e ciascuna di esse deve essere duplicata indipendentemente dalle altre. Quando l'intero patrimonio di DNA della cellula (genoma) e' stato duplicato la cellula puo' dividersi in due cellule figlie e trasmettere a ciascuna una copia completa del suo DNA.
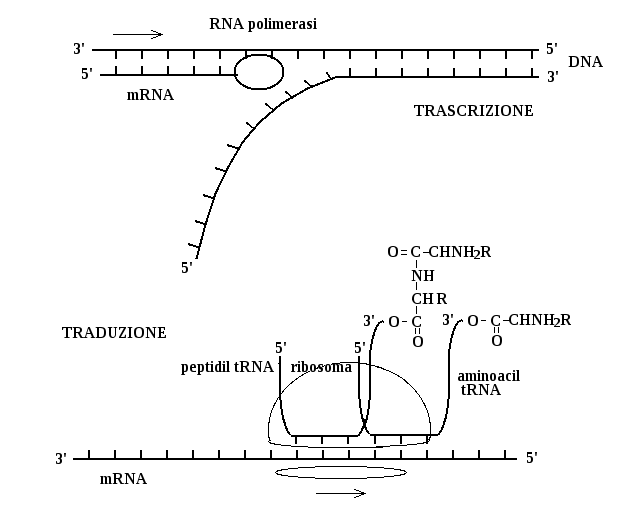
La biosintesi delle proteine e' un altro esempio di sintesi di eteropolimeri e utilizza anch'essa l'informazione contenuta nel DNA. Avviene in due processi distinti, la trascrizione e la traduzione.
LA TRASCRIZIONE. Nella trascrizione un segmento della doppia elica del DNA (gene) viene separato nei due filamenti che lo costituiscono e uno di questi viene utilizzato come stampo per la sintesi di un filamento di RNA di sequenza complementare. L'enzima che opera questa sintesi e' la RNA polimerasi, che deve riconoscere una specifica sequenza nucleotidica di inizio del gene chiamata PROMOTORE, a cui legarsi. Il prodotto della RNA polimerasi e' una molecola di RNA messaggero (mRNA). Lo mRNA va in genere incontro ad un processo di maturazione perche' puo' essere costituito di segmenti inutili alla biosintesi proteica (introni) che devono essere eliminati.
LA TRADUZIONE. Lo mRNA maturo si combina con un complesso multienzimatico contenente RNA e proteine presente nel citoplasma cellulare e chiamato RIBOSOMA. Il ribosoma e' costituito da due subunita', una leggera e una pesante e si chiude sopra lo mRNA per leggerlo; la funzione del ribosoma e' quella di appaiare ad ogni terna di basi (tripletta o codone) dello mRNA un piccolo RNA (RNA di trasferimento, tRNA), in modo che si accoppino esattamente tre basi del primo con tre basi del secondo. Il tRNA porta alla sua estremita' C3' un aminoacido legato con legame estere che viene utilizzato per formare la catena polipeptidica nascente. Due aminoacil-tRNA sono ospitati contemporaneamente nel ribosoma in due siti contigui ed il ribosoma scorre lungo il filamento di mRNA di tripletta in tripletta mantenendo sempre legata al tRNA la catena polipeptidica nascente. Quando il ribosoma raggiunge una tripletta che non corrisponde a nessun tRNA (tripletta di stop), la catena polipetidica nascente si distacca dal ribosoma e forma la proteina neosintetizzata.
Ci sono due momenti cruciali nell'accoppiamento tra triplette di basi dello mRNA e aminoacidi della proteina nascente: il primo e' la biosintesi dell'aminoacil-tRNA che viene effettuata da un enzima specifico per ogni tripletta, l'aminoacil-tRNA sintetasi. Questo enzima si combina con un tRNA (riconosciuto per la tripletta di basi che si accoppia con quella del mRNA: l' "antitripletta") e con un aminoacido e lega i due con legame estere tra il gruppo carbossilico dell'aminoacido e il gruppo ossidrilico sul C3' dell'ultimo nucleotide. Il secondo momento cruciale e' l'accoppiamento della tripletta sullo mRNA con l'antitripletta sull'aminoacil-tRNA, che e' garantito dall'allineamento forzato tra mRNA e tRNA all'interno del ribosoma.
IL CODICE GENETICO. Da quanto e' stato detto consegue che ogni gruppo di tre nucleotidi consecutivi nello mRNA (e quindi anche nelle porzioni codificanti del DNA) corrisponde una antitripletta del tRNA e un aminoacido nella proteina. Esiste quindi un "codice" che associa ciascuna delle 64 possibili triplette (le possibili permutazioni di quattro basi in gruppi di tre sono 43) a uno dei 20 aminacidi proteici. Tre delle 64 possibili triplette non corrispondono a nessun tRNA e sono segnali di stop; le rimanenti 61 sono assegnate ai 20 aminoacidi proteici secondo il CODICE GENETICO, che e' universale ed identico per tutti gli organismi viventi. Ovviamente piu' triplette possono codificare per lo stesso aminoacido: questo rende il codice genetico "degenerato":
| | ||||
| seconda base: | ||||
| prima base : | U | C | A | G |
| U | UUU: Phe | UCU: Ser | UAU: Tyr | UGU: Cys |
| U | UUC: Phe | UCC: Ser | UAC: Tyr | UGC: Cys |
| U | UUA: Leu | UCA: Ser | UAA: stop | UGA: stop |
| U | UUG: Leu | UCG: Ser | UAG: stop | UGG: Trp |
| C | CUU: Leu | CCU: Pro | CAU: His | CGU: Arg |
| C | CUC: Leu | CCC: Pro | CAC: His | CGC: Arg |
| C | CUA: Leu | CCA: Pro | CAA: Gln | CGA: Arg |
| C | CUG: Leu | CCG: Pro | CAG: Gln | CGG: Arg |
| A | AUU: Ile | ACU: Thr | AAU: Asn | AGU: Ser |
| A | AUC: Ile | ACC: Thr | AAC: Asn | AGC: Ser |
| A | AUA: Ile | ACA: Thr | AAA: Lys | AGA: Arg |
| A | AUG: Met | ACG: Thr | AAG: Lys | AGG: Arg |
| G | GUU: Val | GCU: Ala | GAU: Asp | GGU: Gly |
| G | GUC: Val | GCC: Ala | GAC: Asp | GGC: Gly |
| G | GUA: Val | GCA: Ala | GAA: Glu | GGA: Gly |
| G | GUG: Val | GCG: Ala | GAG: Glu | GGG: Gly |
Da quanto esposto sopra consegue che il flusso dell'informazione genica procede in una direzione ben definita: e' contenuto nel DNA e puo' essere duplicato in altro DNA; dal DNA puo' "scendere" verso il mRNA e da questo verso le proteine; ma non puo' mai risalire dalle proteine al mRNA e al DNA. Ovvero dal gene la cellula puo' ottenere il mRNA e la proteina, ma dalla proteina la cellula non puo' ottenere il mRNA e da quest'ultimo non puo' ottenere il DNA. In pratica il flusso dell'informazione genica puo' procedere soltanto nel verso indicato in figura, mai all'indietro:
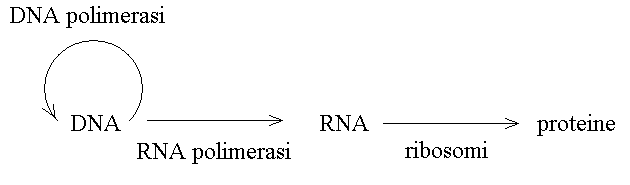
Se prendiamo in considerazione non soltanto le cellule (eucariotiche o procariotiche) ma anche i virus, ed in particolare i retrovirus, osserviamo che il dogma centrale richiede una rielaborazione. Infatti i virus ad RNA sono in grado di duplicare lo RNA ed i retrovirus, grazie alla trascrittasi inversa sono in grado di sintetizzare DNA utilizzando come stampo lo RNA, come rappresentato in figura:

Rimane valido in ogni caso, anche quando si includono nel dogma tutte le complessita' della genetica virale, che non e' possibile sintetizzare RNA o DNA utilizzando l'informazione contenuta nella sequenza delle proteine. Questo passaggio e' oggi possibile all'uomo, con metodi chimici; ma resta vero il fatto che non esiste meccanismo biologico che renda possibile la trasformazione inversa a quella catalizzata nel ribosoma.
Al meccanismo della biosintesi delle proteine descritto sopra conseguono alcune definizioni importanti. Si chiama GENOMA l'insieme di tutto il DNA conteunto nei cromosomi della cellula. Il GENE e' invece il segmento di DNA che contiene la sequenza nucleotidica che codifica per una proteina (insieme con i segmenti di regolazione promotore e terminatore). Ogni cromosoma contiene sequenze di geni e in tutti gli organismi tranne alcuni virus i geni sono di norma presenti in posizioni diverse su entrambi i filamenti della stessa doppia elica. Solo in alcuni virus si ha che tutti i geni sono sullo stesso filamento (chiamato allora filamento +) mentre il filamento complementare serve soltanto per la replicazione.
Alla definizione precedente consegue che ogni doppia elica contiene una sequenza ordinata di geni, e nei diversi individui della stessa specie la sequenze dei geni e' sempre la stessa: ovvero ogni gene occupa una ben definita posizione su un certo cromosoma. La posizione di un gene sul suo cromosoma e' chiamata il LOCUS di quel gene. Questo comporta, ai fini diagnostici, che sia possibile cercare con i metodi della biologia molecolare un certo gene e si possa essere certi di trovarlo sempre sullo stesso cromosoma e nella stessa posizione in qualunque individuo.
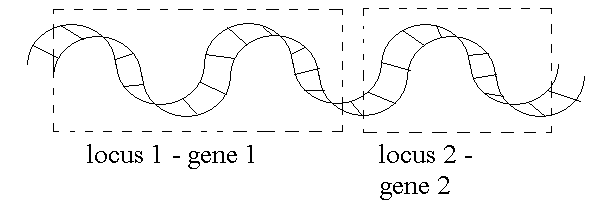
Gli individui della stessa specie differiscono tra loro, pur possedendo gli stessi geni negli stessi loci: questo accade perche' ciascuno di noi possiede specifiche varianti di ciascun gene, chiamate ALLELI.
DIPLOIDIA. Tutti gli organismi superiori sono diploidi, cioe' possiedono i cromosomi in coppie omologhe: uno derivante dal genitore di sesso maschile, l'altro dal genitore di sesso femminile. Ad esempio ogni cellula umana possiede 23 coppie di cromosomi omologhi. Soltanto le cellule sessuali, grazie ad un particolare meccanismo di replicazione chiamato MEIOSI, sono APLOIDI cioe' possiedono un solo cromosoma per ogni tipo (ad esempio nell'uomo le cellule sessuali possiedono 23 cromosomi anziche' 23 coppie), e la fecondazione, cioe' l'unione di un uovo ed uno spermatozoo, produce uno zigote diploide capace di dare origine ad un nuovo organismo diploide. Consegue che ciascun individuo possiede almeno due copie dello stesso gene una di origine paterna, l'altra di origine materna. Alcuni geni sono duplicati e sono presenti in piu' di una copia nel genoma aploide e in piu' di due in quello diploide: ad esempio nel genoma umano diploide sono presenti due copie del gene per la subunita' beta dell'emoglobina, la proteina adibita al trasporto dell'ossigeno (e questo e' il numero minimo) e quattro copie del gene per la subunita' alfa dell'emoglobina.
Poiche' il codice genetico e i meccanismi di biosintesi del DNA e delle proteine sono comuni a tutti gli organismi, dai batteri all'uomo o al grano, e' possibile che avvengano fenomeni di trasferimento genico nei quali due organismi anche non correlati tra loro si scambiano geni e acquisiscono capacita' genetiche che prima non avevano. In natura questo fenomeni avviene in pratica soltanto negli organismi unicellulari (batteri e protozoi) con due modalita': trasferimento genico diretto tra batteri simili oppure trasferimento mediato da virus. IL trasferimento genico diretto tra batteri e' possibile perche' i batteri possono contenere piccole molecole di DNA circolare a doppio filamento, extra-cromosomiale, chiamate plasmidi e possono scambiarsi tra loro questi plasmidi direttamente, mediante una temporanea fusione cellulare o indirettamente rilasciandoli nell'ambiente e captandoli dall'ambiente. Questo fenomeno avviene soprattutto quando c'e' una forte selezione ambientale in favore del plasmide (ad es. quando il plasmide conferisce resistenza ad un antibiotico presente nel mezzo). Il trasferimento mediato da virus avviene quando per un evento anomalo di replicazione un virus capace di ciclo lisogenico incorpora nel suo DNA un pezzo del DNA della cellula ospite, che puo' poi trasferire, dopo un ciclo lisogeno, ad un nuovo ospite.
Un diverso tipo di variazione genetica si ha in quei rari casi nei quali si incrociano tra loro due organismi diversi. Negli animali questi incroci sono sterili (ad es. il mulo che e' l'incrocio tra il cavallo e l'asino), ma nelle piante si possono realizzare organismi capaci di riproduzione.
Gli eventi di variazione genetica "sistematica" come quelli descritti, insieme alle mutazioni causali, sono alla base dei fenomeni evolutivi e sono di grande interesse per gli scopi biotecnologici: molte piante ed animali da allevamento sono varianti geneticamente modificate nel corso dei millenni per permetterne la domesticazione, incrementarne la resa, o adattarle a climi e ambienti diversi da quelli di origine. Questi passaggi di domesticazione sono cosi' complessi che in alcuni casi (ad es. quello del garno e del granoturco) non e' piu' possibile riconoscere con certezza l'antenato selvatico della specie domestica.
L'avvento delle tecniche di manipolazione del DNA reso possibile dalla GENETICA e BOLOGIA MOLECOLARE, ha consentito di ottenere organismi geneticamente modificati in modo scientifico, rispondente ad un progetto, piuttosto che mediante la selezione di eventi casuali. Il metodo e' simile a quello naturale: in genere si utilizzano vettori virali modficati per ottenere eventi di trasferimento genico selettivo, per scopi medici o alimentari. Per scopi pratici si distinguono due tipi di intervento: la produzione di proteine o organismi ricombinanti e la produzione di organismi transgenici. Questa distinzione pero' e' di comodo e tra ricombinante e transgenico non c'e' differenza concettuale.
L'organismo ricombinante utilizzato per scopi medici e' in genere il batterio non patogeno Escherichia coli, nel quale si possono facilmente inserire geni (contenuti in plasmidi) codificanti per varie proteine di interesse. La prima proteina ricombinante prodotta per usi medici e' stata l'ormone insulina che costituisce un buon esempio delle applicazioni pratiche della genetica molecolare. C'e' una malattia umana molto diffusa e grave chiamata diabete mellito di tipo I nella quale le cellule produttrici dell'insulina muoiono per un attacco autoimmune ed il paziente perde la capacita' di produrre questo ormone. Il diabete mellito e' una malattia molto grave che compromette severamente l'aspettativa di vita del paziente; puo' essere trattato mediante somministrazione sottocutanea di insulina (ovviamente non c'e' cura definitiva, perche' non e' possibile far si che il paziente riprenda a produrre insulina: la terapia sostitutiva, di mantenimento). L'insulina e' una proteina e non puo' essere prodotta chimicamente: fino all'inizio degli anni '80 veniva purificata dal pancreas bovino, ottenuto dopo la macellazione dell'animale per scopi alimentari. Ovviamente il paziente trattato in questo modo riceveva insulina bovina, non insulina umana: le due proteine differiscono relativamente poco e l'azione biologica e' la stessa.
All'inizio degli anni '80 e' entrata in produzione INSULINA UMANA RICOMBINANTE, prodotta in batteri Eschericha coli modificati grazie ad un plasmide che reca il gene dell'insulina umana. Con questo trattamento il paziente riceve insulina umana anziche' insulina bovina.
Con le stesse tecniche usate per l'insulina e' possibile produrre anche altri ormoni umani nonche' antigeni proteici di varia natura utili per la produzione di VACCINI SINTETICI RICOMBINANTI. Non tutte le proteine di interesse medico pero' possono essere prodotte mediante questa tecnica. Ad esempio il fattore VIII della coagulazione, necessario nella terapia degli emofilici e' una proteina che subisce estese modifiche post-traduzionali, delle quali il batterio non e' capace: di conseguenza in questo caso la proteina ricombinante e' biologicamente inattiva e inutilizzabile in terapia.
E' possibile inserire geni estranei anche nel genoma di piante ed animali superiori. Il nuovo organismo ricombinante (transgenico) ha interesse per varie applicazioni aggiuntive alla possibile produzione di proteine ricombinanti: ad esempio potrebbe acquisire resistenza contro parassiti o aumentare la sua resa economica o diventare modello di patologie umane per sperimentazione farmacologica o di altro tipo. Gli organismi geneticamente modificati per uso alimentare sono utilizzati in vari paesi (ma non in Europa). Ad esempio sono state prodotte varieta' di riso adatte a climi o ambienti acquatici che sarebbero inospitali per le piante di tipo "selvatico" (in realta' il cosiddetto selvatico e' gia' una varieta' domesticata e quindi modificata dall'uomo, anche se su tempi molto lunghi).
Conviene a questo punto fornire un chiarimento terminologico: si intende per Organismo Geneticamente Modificato (OGM) un organismo che ha subito una manipolazione genetica intenzionale da parte dell'uomo. L'OGM puo' avere interessi medici o alimentari. Quando la modifica e' l'inserimento di un gene (ce ne sono anche altre possibili) l'organismo e' chiamato transgenico; poiche' le proteine prodotte dall'organismo transgenico sono definite ricombinanti, anche il transgenico finalizzato alla produzione di proteine e' chiamato organismo ricombinante e in linea di massima i termini ricombinante e transgenico sono pressoche' sinonimi.
Sono possibili modificazioni genetiche semi-stabili diverse dall'inserimento di geni ricombinanti. Una tra le piu' importanti e' il SILENZIAMENTO genico, ottenuto con vari metodi, che comporta il blocco dell'espressione di uno o piu' geni e quindi, in ultima analisi la carenza nella cellula (o nell'intero organismo) di una o piu' proteine. Anche questa metodica ha per lo piu' interesse sperimentale in quanto si presta a realizzare modelli di malattie umane in animali da laboratorio nei quali queste malattie non si verificano. E' ovvio l'interesse di disporre di modelli animali delle malattie umane per la sperimentazione delle terapie innovative.
Errori nella duplicazione del DNA sono possibili: la DNA polimerasi umana inserisce un nucleotide "sbagliato" (cioe' non esattamente complementare a quello presente sul filamento "stampo") ogni milione di nucleotidi corretti. Quando questo avviene si ha una MUTAZIONE PUNTIFORME. Le cause delle mutazioni sono varie: un esempio e' la possibile tautomeria cheto-enolica dei nucleotidi. Se la mutazione avviene in una cellula somatica, essa nella maggioranza dei casi non ha conseguenze patologiche per l'organismo; raramente pero' puo' essere causa di tumori, anche maligni.
Se invece la mutazione avviene in una linea di cellule germinali (ovociti o spermatozoi) e queste vanno incontro alla fecondazione, l'intero organismo che ne deriva e' portatore della mutazione e questo puo' risultare in malattie genetiche, ereditabili. Si considerino i casi seguenti:
1) la mutazione interviene in un segmento non codificante del DNA (cioe' non all'interno di un gene): in questo caso in genere risulta silente e non causa malattie.
2) la mutazione interviene nella regione tradotta di un gene, ma grazie alla ridondanza del codice genetico converte una tripletta in un'altra codificanti entrambe per lo stesso aminoacido. Si ha una variazione genetica ma non una variazione della proteina espressa e quindi nessuna malattia.
3) la mutazione interviene nella regione tradotta di un gene e cambia il significato di una tripletta; la proteina risultante avra' una sostituzione aminoacidica e potrebbe avere attivita' biologica diminuita o anomala (ad esempio: la variante dell'emoglobina chiamata emoglobina S che causa la malattia chiamata anemia a cellule falciformi).
4) la mutazione interviene nella regione tradotta di un gene e cambia una tripletta codificante per un aminoacido in una tripletta di stop. In questo caso la proteina risultante sara' un moncone con lunghezza minore della proteina normale (le manchera' un tratto dell'estermita' C-terminale; ad esempio: alcuni tipi di talassemia)).
5) la mutazione interviene nella regione non tradotta di un gene. In questo caso e' possibile che la sintesi del gene sia meno efficace (il promotore mutante potrebbe essere meno espresso, piu' espresso o espresso in modo non regolato) e il risultato sara' una alterazione della quantita' di proteina presente (fino alla totale assenza; ad esempio: altri tipi di talassemia).
I casi 3, 4 e 5 possono corrispondere a malattie ereditarie. L'evento piu' frequente e' che la proteina codificata dal gene mutante sia meno attiva o presente in minor quantita' della proteina normale e la malattia sara' per "difetto di funzione". Una caratteristica di questo tipo di malattie e' che in genere e' recessivo: cioe' il paziente eterozigote, che possiede un gene normale e uno malato e' clinicamente sano (o quasi) perche' un solo gene funzionante produce abbastanza proteina da evitare la malattia. La malattia genetica si manifesta in quegli individui che ereditano due copie entrambe non funzionanti del gene). Un evento raro e' che il gene mutante produca una proteina la cui funzionalita' anomala disturba la fisiologia della cellula. In questo caso la presenza di una copia del gene normale nel genoma dell'individuo eterozigote non puo' compensare e la condizione e' quella di una malattia dominante, che si manifesta anche quando uno solo dei due geni e' mutato.
Le cellule di uno stesso organismo possiedono tutte lo stesso patrimonio genico (genoma, DNA) ed in teoria da questo punto di vista sono tutte uguali tra loro. Una dimostrazione sperimentale di questo assunto fu data negli anni '60 da Gurdon che fece i primi esperimenti di CLONAZIONE: se si prende un ovocita di rana, se ne uccide il pronucleo con le radiazioni X e lo si sostituisce con il nucleo di una cellula qualsiasi di una rana adulta (ad es. un enterocita), l'ovocita e' in grado di andare incontro all'intero processo di morfogenesi, dando origine a girini normali, geneticamente identici alla rana dalla quale era stato prelevato il nucleo cellulare. Questa osservazione dimostra la TOTIPOTENZA del genoma delle cellule differenziate: un enterocita (o qualunque altra cellula) contiene nel suo nucleo l'informazione genetica necessaria e sufficiente all'intero organismo.
Le differenze tra i diversi tipi cellulari dell'organismo sono dunque non genetiche: ogni cellula potrebbe in teoria produrre tutte le proteine dell'organismo, ma ne produce in pratica solo alcune e non altre, e i diversi tipi cellulari sono caratterizzati ciascuno dall'espressione selettiva di un certo numero di geni caratteristici. Il problema dell'espressione genica selettiva e' un aspetto particolare del piu' generale problema della regolazione dell'espressione genica (o della regolazione della sintesi proteica). L'esempio piu' classico e meglio caratterizzato di meccanismo di regolazione dell'espressione genica e' dato dalla regolazione dell'Operone Lac di Escherichia coli.
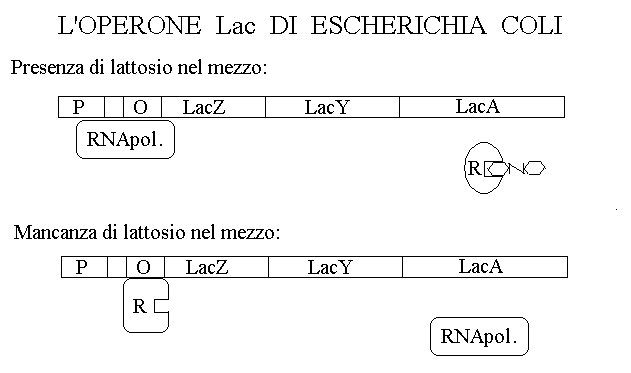
E. coli e' un batterio ospite del nostro intestino, capace di crescere su terreni molto poveri, utilizzando zuccheri come sorgente di energia metabolica. Lo zucchero preferito da E. coli e' il glucosio, ma il batterio puo' adattarsi a crescere in terreni contenenti lattosio. Per fare questo utilizza tre enzimi specifici: la beta-galattosidasi (codificata dal gene LacZ) che idrolizza il lattosio in galattosio e glucosio; la galattopermeasi (codificata dal gene LacY) che trasporta il galattosio all'interno della cellula e la beta-galattoside transacetilasi (codificata dal gene LacA). Questi tre enzimi sono codificati da tre geni contigui, che appartengono ad un unico OPERONE, chiamato Lac, e sono quindi trascritti e tradotti insieme. L'aspetto interessante di questo esempio e' che l'operone Lac viene trascritto e tradotto solo se serve, cioe' se e' presente lattosio nel mezzo di cultura, mentre non e' trascritto ne' tradotto se nel mezzo di cultura sono presenti altri zuccheri. In che modo la presenza del lattosio regola l'espressione dell'operone Lac?
La sequenza genica dell'operone Lac include, oltre ai tre geni degli enzimi citati sopra (LacZ, LacY e LacA) il PROMOTORE, l'OPERATORE. Il meccanismo di regolazione della biosintesi dell'operone richiede la presenza del REPRESSORE, una proteina allosterica che puo' combinarsi o con il lattosio o con il DNA a livello della sequenza chiamata OPERATORE, ma non con entrambi. Se nel mezzo di cultura e' presente lattosio il repressore si lega al lattosio e libera la sequenza operatore; questo consente il legame della RNA-polimerasi a livello del promotore, e quindi la produzione del mRNA. Se nel mezzo di cultura non è presente il lattosio il repressore si lega invece al sito operatore e impedisce l'attacco della RNA-polimerasi e quindi la trascrizione dell'operone. Nel caso in cui nel mezzo sia presente il lattosio e quindi sia resa possibile la trascrizione dell'operone Lac il repressore e' legato con lattosio e la RNA-polimerasi e' legata alla sequenza di DNA dell'operone; in assenza di lattosio invece, il repressore e' legato al sito operatore dell'operone e la trascrizione non puo' avere luogo. Il meccanismo di regolazione dell'operone Lac e' chiamato negativo, perche' basato sulla repressione della biosintesi; esistono anche meccanismi positivi nei quali al posto del repressore si trova un attivatore della trascrizione. In ogni caso e' importante sottolineare che sia la lettura del DNA (operata dalla RNA-polimerasi) che la sua regolazione (operata da repressori o attivatori) sono affidate ad enzimi.
Il metabolismo e' un sistema assai complesso di reazioni chimiche caratteristiche delle cellule viventi, che puo' avere lo scopo di produrre energia (attraverso la degradazione di molecole complesse: CATABOLISMO) o di produrre composti chimici necessari alla sopravvivenza della cellula (ANABOLISMO). Con la decifrazione del genoma umano, completata nel 2000, e' stato dimostrato che l'uomo e' in grado di produrre circa 30.000 proteine diverse, in maggioranza enzimi. E' quindi ragionevole stimare che le reazioni chimiche che le nostre cellule sono in grad di catalizzare siano in tutto circa 20.000: questo da un'idea della complessita' del metabolismo.
Le circa 20.000 reazioni chimiche catalizzate da enzimi che costituiscono il metabolismo non avvengono disordinatamente, ma sono organizzate in sequenze, chiamate vie o cicli metabolici, nelle quali il prodotto di ciascuna reazione costituisce il reagente della successiva. Nel testo che segue sono illustrate a titolo di esempio solo alcune tra le principali vie metaboliche per un totale di meno di 50 reazioni biochimiche.
LA GLICOLISI. La glicolisi e' il processo metabolico nel quale il glucosio viene degradato per produrre energia. Avviene nel citoplasma di tutte (o quasi tutte) le cellule viventi. Come tutte le VIE METABOLICHE, e' una sequenza di reazioni chimiche nella quale il prodotto di ciascuna reazione costituisce il reagente della successiva; ogni reazione richiede uno specifico enzima. Il prodotto finale della via metabolica e' l'acido PIRUVICO, che puo' venire ulteriormente trasformato in acetil-CoA ed utilizzato nel ciclo di Krebs per sfruttarne ulteriormente il contenuto di energia chimica. Le reazioni della glicolisi sono le seguenti:
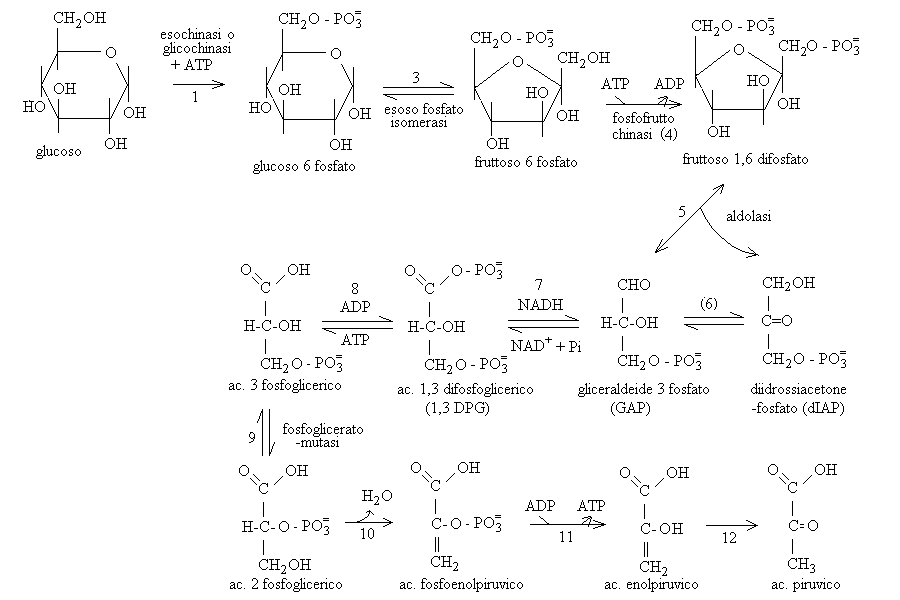
La reazione 1 puo' essere catalizzata da due enzimi alternativi: la glicochinasi o l'esochinasi e trasforma il glucosio in glucosio-6-fosfato con consumo di energia (una molecola di ATP e' convertita in ADP). Questa reazione e' irreversibile. Lo schema prevede anche un possibile percorso alternativo per produrre il glucosio-6-fosfato a partire dal glucosio-1-fosfato derivante dalla degradazione del glicogeno (reazione 2, catalizzata dalla fosfoglucomutasi; non riportata in figura).
Il glucosio-6-fosfato viene convertito nel suo isomero fruttosio-6-fosfato dall'enzima esoso fosfato isomerasi (reazione 3, reversibile). La reazione 4 (irreversibile, catalizzata dalla fosfofruttochinasi) converte il fruttosio-6-fosfato in fruttosio-1,6-difosfato con consumo di un'altra molecola di ATP (che viene convertita in ADP). La fosfofruttochinasi e' l'enzima che regola il funzionamento dell'intera glicolisi; viene inibito dall'ATP (questo premette alla cellula di interrompere la via metabolica se le riserve energetiche sono abbondanti) e attivato dall'ADP (una elevata concentrazione intracellulare di ADP segnala che le riserve energetiche sono scarse, e implica che e' necessario attivare la glicolisi, la cui funzione e' produrre energia). Fino a questo punto la glicolisi ha avuto un costo energetico: ha consumato 2 molecole di ATP.
Il fruttosio-1,6-difosfato e' il substrato dell'aldolasi che lo scinde in due triosi-fosfato: la gliceraldeide-3-fosfato e il diidrossi acetone fosfato (reazione 5); i due triosi fosfati possono essere convertiti l'uno nell'altro grazie all'enzima triosofosfato isomerasi (reazione 6, reversibile). Quest'ultima reazione e' importante perche' soltanto la gliceraldeide-3-fosfato puo' essere ulteriormente utilizzata nella glicolisi e quindi in assenza della trioso fosfato isomerasi il diidrossi acetone fosfato sarebbe sprecato.
Nella reazione 7 l'enzima gliceraldeide-3-fosfato deidrogenasi trasforma la gliceraldeide-3-fosfato in acido 1,3-difosfoglicerico. La reazione (reversibile) e' una ossidoriduzione (si ha l'ossidazione di una aldeide all'acido carbossilico corrispondente) e libera energia, che viene utilizzata simultaneamente in due modi: (a) riduce una molecola di NAD+ a NADH; il NADH e' una sorgente di energia per reazioni di ossidoriduzione e puo' anche essere convertito in ATP nella fosforilazione ossidativa (vedi oltre); (b) forma un legame di tipo anidridico ad alta energia tra l'acido 3-fosfoglicerico ed una molecola di acido fosforico. L'energia del legame anidridico e' utilizzata dalla fosfoglicerato chinasi che trasferisce il fosfato dall'acido 1,3-fosfoglicerico all'ADP, producendo acido 3-fosfoglicerico ed ATP (reazione 8).
L'enzima fosfoglicerato mutasi sposta l'acido fosforico dal C3 al C2 dell'acido glicerico; la reazione (n.9) e' reversibile ed il suo prodotto, acido 2-fosfoglicerico e' il substrato di una enolasi che lo converte in acido fosfoenolpiruvico rimuovendo una molecola d'acqua (cioe' rimuove un H ed un OH, che vengono legati insieme in H2O, ed introduce un doppio legame tra due atomi di carbonio; reazione 10). La fosfoenolpiruvato chinasi trasferisce l'acido fosforico dall'acido fosfoenolpiruvico all'ADP, producendo acido enolpiruvico ed ATP (reazione 11); l'acido enolpiruvico si isomerizza spontaneamente ad acido piruvico (reazione 12, unica reazione non catalizzata di questa via metabolica).
BILANCIO ENERGETICO DELLA GLICOLISI. Ogni molecola di glucosio che entra in questa via metabolica costa alla cellula 2 molecole di ATP (reazioni 1 e 4). Pero' nel proseguimento della glicolisi ogni molecola di trioso fosfato rende 2 molecole di ATP (reazioni 8 e 11) e riduce una molecola di NADH (reazione 7); e poiche' da ogni molecola di glucosio si producono due triosi il bilancio della fase attiva della glicolisi e' di 4 ATP e 2 NADH. Sottraendo il costo iniziale di 2 ATP si ottiene il bilancio energetico netto della glicolisi:
C6H12O6 + 2 ADP + 2 H3PO4 + 2 NAD+ --> 2 C3H4O3 + 2 ATP + 2 NADH + 2 H+
IL CICLO DI KREBS (o ciclo degli acidi tricarbossilici). E' una via metabolica fondamentale per tutte le cellule eucariotiche ed avviene nei mitocondri, organelli intracellulari specializzati nella produzione di energia. Il mitocondrio e' rivestito da due membrane e provvisto di DNA proprio, distinto da quello nucleare; la sua origine remota e' quella di un batterio simbionte e nella cellula ospite e' responsabile delle reazioni della respirazione cellulare. Ogni cellula eucariotica contiene moltissimi mitocondri.
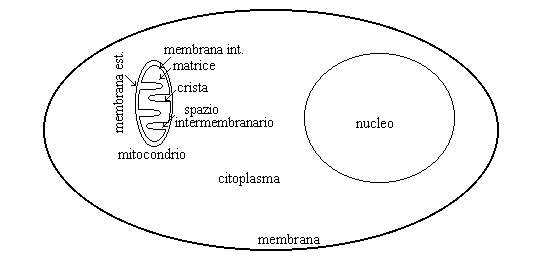
Il ciclo di Krebs ossida a CO2 i due atomi di carbonio di una molecola di acido acetico. Per poter entrare nel ciclo l'acido acetico deve essere preventivamente combinato con un cofattore, il coenzima A che possiede un gruppo tiolico molto reattivo ed e' pertanto in genere rappresentato come CoA-SH. IL legame tra il CoA-SH e l'acido acetico e' il tioestere: CH3-CO-S-CoA (e la molecola cosi' fomata e' chiamata acetil-CoA). L'acetil-CoA puo' essere prodotto dalla β - ossidazione degli acidi grassi, oppure a partire dall'acido piruvico prodotto dalla glicolisi, nella reazione seguente (catalizzata dall'enzima piruvato decarbossilasi):
C3H4O3 + CoA-SH + NAD+ --> CO2 + CH3-CO-S-CoA + NADH + H+
Il ciclo comincia con la combinazione dell'acetil-CoA con una molecola di acido ossalacetico. La reazione, indicata come 1 nello schema qui sotto, e' catalizzata dalla citrato sintetasi e restituisce una molecola di coenzima A e una di acido citrico. Il coenzima A liberato viene riutilizzato per produrre altre molecole di acetil-CoA.
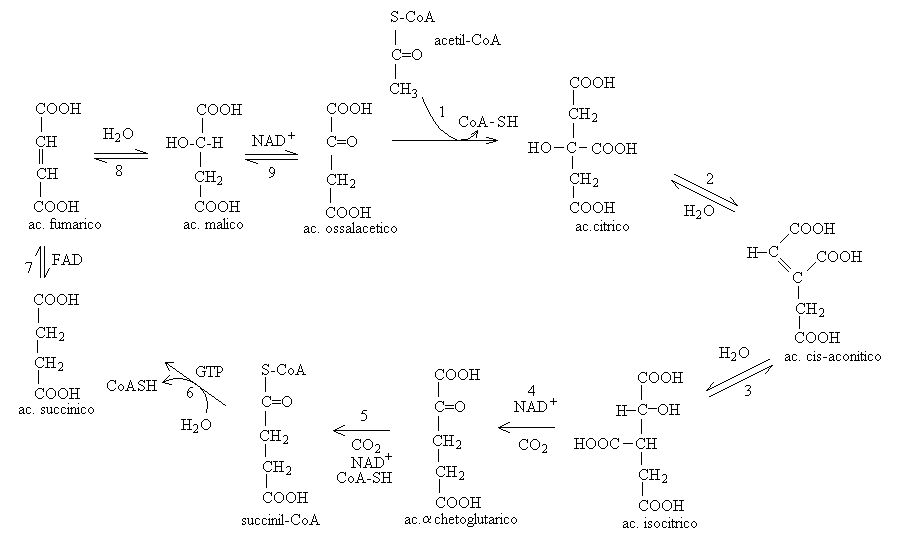
L'acido citrico viene convertito in cis-aconitico (reazione 2) e questo ancora in acido isocitrico (reazione 3); entrambe le reazioni sono disidratazioni-reidratazioni reversibili ed entrambe sono catalizzate dallo stesso enzima, l'aconitasi, la cui azione consiste nell'estrarre o reintrodurre una molecola d'acqua al posto di un doppio legame (si confronti questa reazione con quella catalizzata dall'enolasi, reazione 10 della glicolisi). L'effetto finale e' lo spostamento di un gruppo OH (dal C3 nell'acido citrico al C2 nell'isocitrico).
L'acido isocitrico va incontro a due decarbossilazioni successive: la prima, operata dalla isocitrato deidrogenasi (reazione 4), produce CO2, acido α - chetoglutarico e riduce una molecola di NAD+ a NADH; la seconda, operata dalla α - chetoglutarato deidrogenasi (reazione 5), richiede una molecola di CoA-SH e produce CO2, succinil-CoA; inoltre riduce un'altra molecola di NAD+ a NADH.
A questo punto le due molecole di CO2 sono state prodotte e lo scopo delle reazioni ulteriori e' quello di riformare la molecola di acido ossalacetico utilizzata dalla citrato sintetasi per permettere la chiusura del ciclo. L'enzima succinico sintetasi distacca il coenzima A dall'acido succinico e utilizza l'energia del legame tioestere per fosforilare una molecola di GDP che viene trasformata in GTP (reazione 6). La succinico deidrogenasi estrae due atomi di idrogeno dall'acido succinico e li trasferisce ad un cofattore chiamato FAD (che viene di conseguenza ridotto a FADH2), mentre l'acido succinico e' trasformato in acido fumarico (reazione 7). L'acido fumarico viene idratato ad acido malico ad opera dell'enzima fumarasi (reazione 8), ed infine la malico deidrogenasi converte l'acido malico in acido ossalacetico, riducendo al contempo una molecola di NAD+ a NADH. L'acido ossalacetico cosi' prodotto puo' essere riutilizzato per un nuovo ciclo.
Il bilancio netto del ciclo di Krebs risulta pertanto:
CH3-CO-S-CoA + 3 NAD+ + FAD + GDP + H3PO4 + 3 H2O--> 2 CO2 + CoA-SH + 3 NADH + 3 H+ + FADH2 + GTP
PRODUZIONE DELL'ACIDO OSSALACETICO. In alcune circostanze i metaboliti del ciclo di Krebs possono essere sottratti al ciclo e destinati ad altri usi: ad es. l'acido α - chetoglutarico puo' essere convertito nell'aminoacido chiamato acido glutammico mediante transaminazione e quest'ultimo puo' essere utilizzato per la sintesi proteica. Come conseguenza di queste reazioni, accade che il ciclo si interrompe e viene perduta una molecola di acido ossalacetico, che deve quindi essere sostituita. Questo e' possibile grazie alla carbossilazione del piruvato, catalizzata dalla piruvato carbossilasi, che utilizza una molecola di ATP. La reazione e' la seguente:
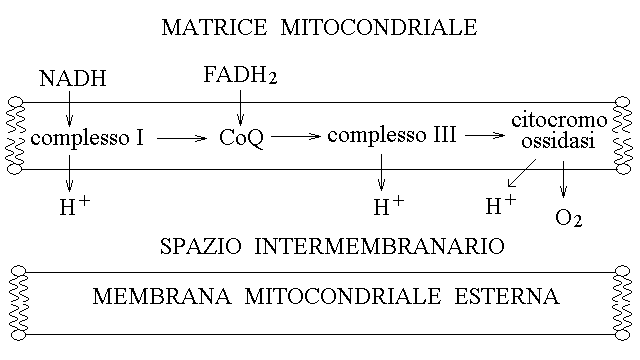
FOSFORILAZIONE OSSIDATIVA: LA CATENA RESPIRATORIA. Sebbene il NADH prodotto nel ciclo di Krebs sia gia' una possibile forma di energia chimica, direttamente utilizzabile nelle reazioni di ossido-riduzione, esso viene prodotto in grande eccesso rispetto alle necessita'. Consegue che la cellula deve rigenerare il NAD+ per poter continuare a far funzionare il ciclo di Krebs e al tempo stesso deve convertire l'energia potenziale contenuta nel NADH in ATP. La fosforilazione ossidativa soddisfa entrambe queste necessita', grazie all'intervento di enzimi distinti: la CATENA RESPIRATORIA catalizza il trasferimento di elettroni dal NADH o dal FADH2 all'ossigeno che respiriamo (che viene convertito in H2O) e crea un gradiente di ioni idrogeno tra i due compartimenti del mitocondrio (la matrice e lo spazio intermembranario); la F0-F1 ATPasi dissipa il gradiente di ioni idrogeno creato dalla catena respiratoria e ne sfrutta l'energia per produrre ATP.
La reazione complessivamente catalizzata dalla catena respiratoria e': 4 H+ + 4 e- + O2 --> H2O.
Il flusso degli elettroni nella catena respiratoria segue il seguente percorso: NADH --> complesso I --> Coenzima Q --> complesso III --> citocromo c --> citocromo ossidasi --> ossigeno. Quando il donatore di elettroni e' il FADH2 gli elettroni vengono donati ad un altro enzima, il complesso II, il quale li trasferisce al coenzima Q; di qui in poi il destino degli elettroni e' lo stesso che per il NADH.
Gli enzimi della catena respiratoria (si tratta in effetti di complessi multienzimatici) si trovano sulla membrana mitocondriale interna e accoppiano il il trasporto degli elettroni al trasferimento di ioni idrogeno dalla matrice allo spazio intermembranario, con la conseguenza che la matrice diventa basica e lo spazio intermembranario diventa acido:
FOSFORILAZIONE OSSIDATIVA: LA SINTESI DELL'ATP. Il gradiente di pH generato dalla catena respiratoria viene dissipato dalla F0-F1 ATPasi, una pompa per ioni idrogeno che funziona al contrario delle pompe di membrana: anziche' trasferire ioni contro il loro gradiente di concentrazione con consumo di ATP, essa permette agli ioni idrogeno di rientrare dallo spazio intermembranario alla matrice ma accoppia il loro flusso alla biosintesi dell'ATP.
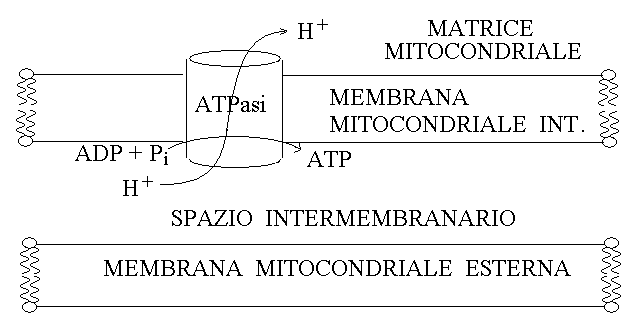
In pratica la riossidazione di ogni molecola di NADH si associa al trasferimento di circa 9 ioni idrogeno dallo spazio intermembranario e la riossidazione di ogni molecola di FADH2 al trasferimento di circa 6 ioni idrogeno nella stessa direzione. La F0-F1 ATPasiassocia il trasferimento di 10 ioni idrogeno alla sintesi di 3 ATP (a partire da ADP e acido fosforico), con un rendimento massimo teorico di 3 ATP/NADH e 2 ATP/FADH2. In condizioni fisiologiche le inevitabili perdite di ioni idrogeno attraverso le membrane biologiche riducono questi rendimenti rispettivamente a circa 2,5 e 1,5.
LA VIA DEI PENTOSO FOSFATI. La via dei pentoso fosfati e' una serie di reazioni del metabolismo alternativa alla glicolisi e al ciclo di Krebs, che porta all'ossidazione del glucoso e alla produzione di intermedi metabolici di grande importanza per la cellula. Le prime tre reazioni di questo importante percorso metabolico comportano produzione di energia, sotto forma di riduzione di due molecole di NADP+ e decarbossilazione di un esoso con produzione di un pentoso. Le razioni successive riarrangiano il pentoso cosi' prodotto in modo che da tre pentosi si ottengano due esosi (fruttosio 6 fosfato) ed un trioso (gliceraldeide 3 fosfato):
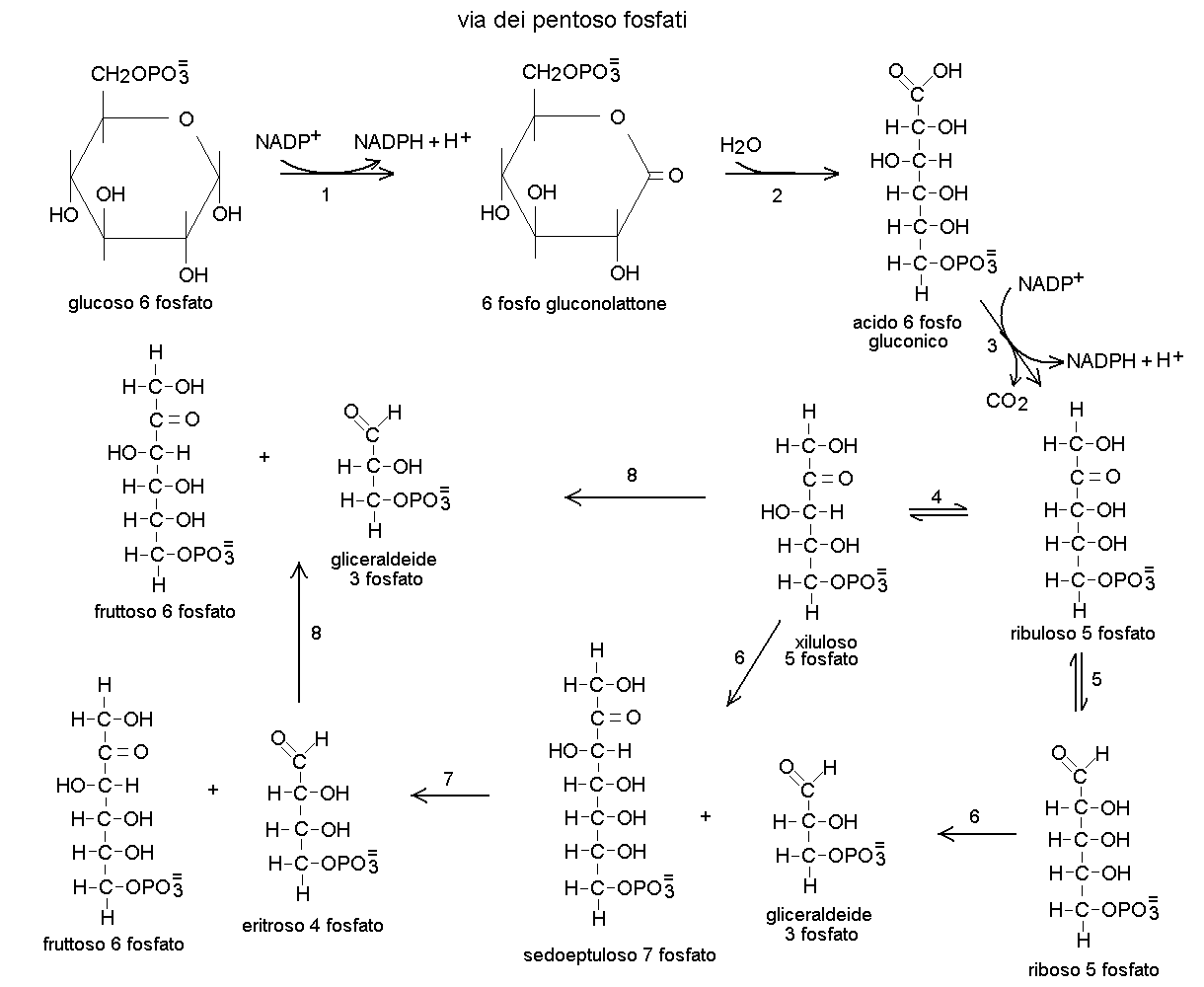
La via metabolica inizia dal glucoso 6 fosfato, prodotto come per la glicolisi. L'enzima glucoso 6 fosfato deidrogenasi (G6PDH; reazione 1) ossida il glucoso 6 fosfato a 6 fosfo gluconolattone, l'estere intramolecolare dell'acido 6 fosfogluconico; in questa reazione una molecola di NADP+ viene ridotta a NADPH. L'enzima 6 fosfo gluconolattonasi idrolizza il lattone e lo converte in acido 6 fosfogluconico (reazione 2). L'acido 6 fosfogluconico viene decarbossilato dalla 6 fosfogluconato deidrogenasi e convertito in ribuloso 5 fosfato (reazione 3), con riduzione di un'altra molecola di NADP+. A questo punto la fase responsabile della produzione di energia e' completata e le ulteriori reazioni del ciclo servono soltanto a convertire il ribuloso in altri zuccheri, di maggiore utilita' per l'organismo; per comprendere il meccanismo di queste reazioni conviene immaginare di aver consumato tre molecole di glucoso 6 fosfato producendone altrettante di ribuloso 5 fosfato. Una molecola di ribuloso 5 fosfato viene convertita in riboso 5 fosfato da una specifica isomerasi (reazione 5); le altre due vengono convertite in xiluloso 5 fosfato da una specifica epimerasi (reazione 4). L'enzima transchetolasi trasferisce due atomi di C dallo xiluloso 5 fosfato al riboso 5 fosfato; i prodotti di reazione sono un chetoso a 7 atomi di carbonio, il sedopetuloso 7 fosfato e la gliceraldeide 3 fosfato (reazione 6). L'enzima transaldolasi sposta tre atomi di C dal sedoeptuloso 7 fosfato alla gliceraldeide 3 fosfato; i prodotti sono fruttoso 6 fosfato ed (reazione 7). Infine e' ancora la transchetolasi a spostare due atomi di C dallo xiluloso 5 fosfato all'eritroso 4 fosfato: per produrre fruttoso 6 fosfato e gliceraldeide 3 fosfato (reazione 8). In pratica in questa fase del ciclo da tre pentosi (contenenti in totale 15 atomi di C) sono stati prodotti due esosi ed un trioso (contenenti complessivamente 15 atomi di C), secondo lo schema: C5 + C5 --> C7 + C3 --> C6 + C4 ; C5 + C4 --> C6 + C3.
Il fruttoso 6 fosfato prodotto in questo modo puo' essere isomerizzato a glucoso 6 fosfato e reimmesso nella stessa via metabolica; se questo avviene, il bilancio energetico puo' essere calcolato immaginando di far avvenire questo metabolismo su 6 molecole di glucoso 6 fosfato che vengono convertite in 5 molecole di fruttoso 6 fosfato e 6 molecole di CO2 con riduzione di 12 NADP+. Per fare questo naturalmente e' necessario convertire due triosi in un esoso (grazie agli enzimi della glicolisi trioso fosfato isomerasi e aldolasi). L'aspetto piu' interessante di questo ciclo e' pero' la sua capacita' di produrre, oltre all'energia conservata nel NADPH, intermedi metabolici di grande importanza, quali il ribosio necessario alla biosintesi dei ribonucleotidi e dei desossiribonucleotidi o la gliceraldeide 3 fosfato.
GLICONEOGENESI. La gliconeogenesi e' la biosintesi del glucosio a partire da composti di natura non glicidica. Nel nostro organismo l'unico composto adatto e' l'acido piruvico che puo' essere usato per ripercorrere all'indietro le varie tappe della glicolisi. Specifici enzimi sono necessari per aggirare le reazioni irreversibili, con consumo di energia:
1) la conversione del piruvato in fosfoenolpiruvato e' la piu' complessa e richiede due enzimi ed un intermedio: nella prima reazione, catalizzata dalla piruvato carbossilasi, l'acido piruvico viene convertito in acido ossalacetico, con consumo di ATP e CO2 (questa reazione e' stata descritta sopra: si veda la "produzione dell'acido ossalacetico"). Nella seconda reazione, catalizzata dall'enzima fosfoenolpiruvato carbossichinasi l'acido ossalacetico viene convertito in fosfoenolpiruvico con consumo di una molecola di ATP e produzione di una molecola di CO2. Una ulteriore peculiarita' di questa sequenza di reazioni e' che la prima reazione avviene nel mitocondrio mentra la seconda nel citoplasma (dove del resto avvengono il resto della gliconeogenesi e tutta la glicolisi). Per trasportare l'acido ossalacetico nel citoplasma questo viene transientemente convertito in acido malico e poi di nuovo in ossalacetico (secondo la sequenza: ossalacetico nel mitocondrio -> malico nel mitocondrio -> trasporto -> malico nel citoplasma -> ossalacetico nel citoplasma).
2) La conversione di fruttosio 1-6 difosfato in fruttosio 6 fosfato non avviene con produzione di ATP grazie alla fosfofruttochinasi, ma con semplice idrolisi dell'estere fosforico (catalizzata dalla fruttosio 1-6 difosfato fosfatasi).
Come conseguenza di questo meccanismo biosintetico, l'organismo puo' convertire in zuccheri soltanto quegli alimenti che possono essere trasformati in acido piruvico: in pratica altri zuccheri, aminoacidi glicogenici e un piccolo numero di acidi carbossilici e alcoli contenuti in alimenti di origine vegetale. La conversione di zuccheri in altri zuccheri e' ovvia, e avviene solo in particolari circostanze fisiologiche (ciclo di Cori); quella degli acidi carbossilici poco rilevante: i composti di maggiore interesse per questo metabolismo sono gli aminoacidi glicogenici. Un tipico esempio di aminoacido glicogenico e' l'alanina che puo' essere convertita in acido piruvico da una specifica transaminasi, la glutamico piruvico transaminasi; la reazione catalizzata da questo enzima e':
CH3-CHN2-COOH + COOH-CH2-CH2-CO-COOH <==> CH3-CO-COOH + COOH-CH2-CH2-CHN2-COOH
Si vede che i reagenti di questa reazione completamente reversibile sono alanina e acido alfa chetoglutarico (un metabolita del ciclo di Krebs), i prodotti acido piruvico e acido glutamico.
L'importanza della gliconeogenesi e' la seguente: tutti gli organi richiedono glucoso per il loro metabolismo; alcuni come il cervello utilizzano soltanto questo zucchero, altri come il muscolo scheletrico e cardiaco utilizzano prevalentemente acidi grassi e soltanto una piccola frazione del loro metabolismo e' affidata al glucoso; ma nessun organo puo' fare completamente a meno di questo zucchero. Se la dieta fornisce zuccheri in quantita' adeguata (non meno di 100 g/die nell'adulto) il glucoso utilizzato nel metabolismo viene dall'alimentazione; in caso contrario deve essere prodotto a partire dalle proteine del tessuto muscolare. Consegue che la dieta, anche se con restrzione calorica, deve fornire una quantita' adeguata di zuccheri; in caso contrario si otterra' diminuzione della massa muscolare anziche' consumo delle riserve adipose. Di fatto il miglior modo per dimagrire (per chi ne ha bisogno) e' una dieta con moderata restrizione calorica associata ad esercizio fisico (il muscolo e' il principale consumatore dei trigliceridi contenuti nel tessuto adiposo), mentre sono da sconsigliarsi le riduzioni estreme dell'apporto calorico e le diete sbilanciate nella composizione dei diversi nutrienti.
LA β - OSSIDAZIONE DEGLI ACIDI GRASSI. La maggior parte delle riserve energetiche del nostro organismo e' accumulata nel tessuto adiposo sotto forma di trigliceridi. Nel momento in cui l'organismo deve attingere a questa riserva (intervalli tra i pasti; condizioni di dieta ipocalorica o di digiuno) i trigliceridi vengono immessi nel circolo sanguigno legati alle lipoproteine plasmatiche e sono captati dalle cellule che li richiedono. All'interno della cellula i trigliceridi vengono scissi da una lipasi in glicerolo e acidi grassi; il glicerolo viene ossidato a diidrossiacetone e avviato verso la glicolisi, mentre gli acidi grassi vengono coniugati con il coenzima A e, nella forma di acil-CoA, entrano in un percorso metabolico chiamato β - ossidazione che li converte in molecole di acetil-CoA (che vengono quindi avviate al ciclo di Krebs. Per ogni acido grasso a numero pari di atomi di carbonio, la β - ossidazione viene ripetuta un numero di volte pari alla meta' meno uno del numero di atomi di carbonio e viene prodotto un numero di molecole di acetil-CoA pari alla meta' del numero degli atomi di carbonio. Lo schema delle reazioni della β - ossidazione e' il seguente:
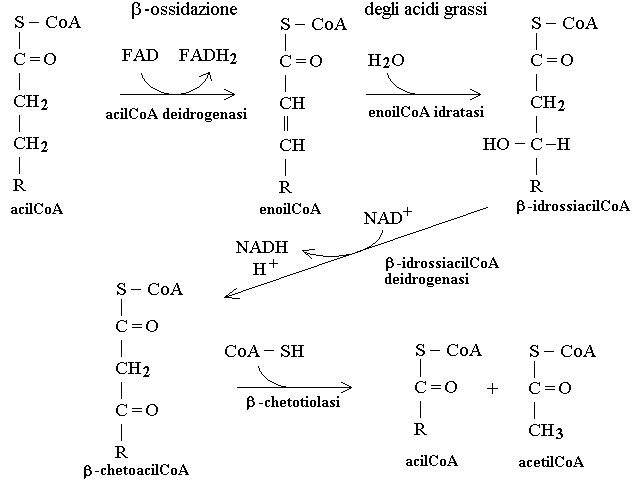
E' importante osservare che la β - ossidazione produce acetilCoA che puo' essere avviato direttamente al ciclo di Krebs, ma non acido piruvico: apparentemente gli animali non possiedono nessun enzima capace di convertire acetilCoA o acido acetico in acido piruvico. Di conseguenza, non e' possibile utilizzare gli acidi grassi per ripristinare l'acido ossalacetico che venisse sottratto al ciclo di Krebs (vedi sopra: produzione dell'acido ossalacetico). Per questo motivo nessun tessuto puo' utilizzare per il suo metabolismo soltanto acidi grassi: il consumo di acidi grassi deve essere accompagnato da un consumo almeno minimo di glucosio.
CATABOLISMO DEL PROPANOIL-CoA. Nel caso (raro) di acidi grassi a numero dispari di atomi di carbonio, la β - ossidazione si ferma ad una molecola di propanoil-CoA, dalla formula: CH3-CH2-CO-S-CoA. Il propanoil-CoA non puo' essere trasformato con un ulteriore ciclo della β - ossidazione e segue un destino diverso: viene carbossilato dall'enzima propanoil-CoA carbossilasi e convertito in metilmalonil-CoA (HOOC-CH(CH3)-CO-SCoA); quest'ultimo viene trasformato in succinil-CoA dalla metil malonil-CoA mutasi. Il succinil-CoA e' un metabolita del ciclo di Krebs e viene quindi ossidato in questo ciclo (ed e' questo l'unico caso in cui un acido grasso puo' produrre acido ossalacetico).
BIOSINTESI DEGLI ACIDI GRASSI. La biosintesi degli acidi grassi segue quasi esattamente le stesse tappe della β - ossidazione, percorrendola in direzione inversa; pero' e' catalizzata da un sistema enzimatico completamente distinto ed indipendente da quello della β - ossidazione. Le principali differenze tra la β - ossidazione e la biosintesi degli acidi grassi sono le seguenti:
1) i sistemi enzimatici responsabili delle due vie metaboliche sono diversi, sebbene la sequenza delle reazioni da essi catalizzate sia la stessa;
2) e' richiesto un intermedio biosintetico in piu' rispetto alla β - ossidazione, il malonil-CoA (HOOC-CH2-CO-S-CoA) che viene prodotto a partire dall'acetil-CoA in una reazione catalizzata dall'acetil-CoA carbossilasi;
3) il malonil-CoA viene utilizzato dall'enzima multifunzionale acido grasso sintetasi, che catalizza tutte le reazioni successive. Quando il malonil-CoA si lega all'acido grasso sintetasi viene decarbossilato e ritorna un residuo di acido acetico. Il ciclo di carbossilazione-decarbossilazione e' necessario per fornire l'energia richiesta alla combinazione del substrato con l'enzima;
4) la β - ossidazione avviene nel mitocondrio, la biosintesi degli acidi grassi nel citoplasma.
Il fatto che il materiale di partenza sia acetil-CoA, la cui carbossilazione e' soltanto transitoria, ha due conseguenze importanti: (a) quasi sempre gli acidi grassi hanno numero pari di atomi di carbonio perche' vengono sintetizzati unendo tra loro un numero variabile di molecole a due atomi di carbonio; (b) e' possibile produrre acidi grassi a partire da zuccheri o da aminoacidi: infatti tutti questi composti possono essere convertiti in ac. piruvico e questo in acetil-CoA (dalla piruvico deidrogenasi) o, per gli aminoacidi lipogenici, direttamente in acetil-CoA. Per contro il nostro organismo non possiede enzimi capaci di convertire l'acetil-CoA in piruvato e quindi non e' possibile sitetizzare zuccheri o aminoacidi a partire dagli acidi grassi.
BIOSINTESI DEL COLESTEROLO. Il colesterolo e' un componente importante delle membrane cellulari; e' inoltre il precursore degli ormoni steroidei e dei sali biliari. Viene sintetizzato a partire dall'acetil-CoA in una via anabolica alquanto complessa che passa attraverso tre tappe fondamentali: 1) la biosintesi dell'isopentenil pirofosfato (che richiede 5 reazioni, catalizzate da 5 diversi enzimi e tre molecole di acetil-CoA; 2) la polimerizzazione di unita' di isopentenil pirofosfato per formare lo squalene, idrocarburo ramificato poliinsaturo; 3) la ciclizzazione dello squalene:
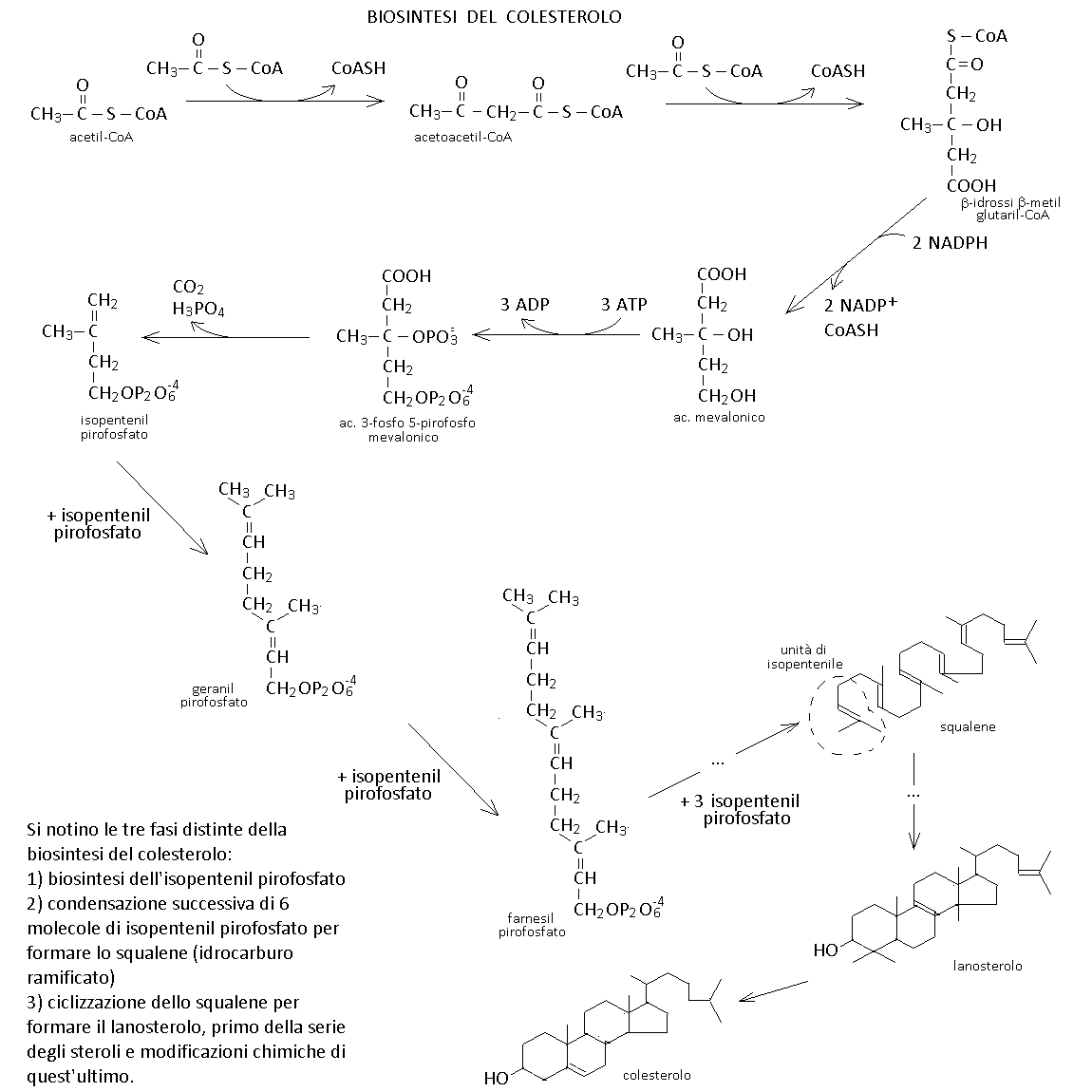
La via metabolica e' regolata dall'enzima beta-idrossi beta-metil glutaril-CoA sintetasi (inibito dai farmaci chiamati statine). Poiche' il colesterolo viaggia nel sangue legato alle lipoproteine e puo' causare danni aterosclerotici alla parete dei vasi arteriosi, la sua concentrazione ematica e' regolata e di norma non supera i 250 mg/100 mL.
IL CATABOLISMO DEGLI AMINOACIDI. Gli aminoacidi derivanti dalla digestione delle proteine di origine interna o alimentare possono essere deaminati ed il loro scheletro carbonioso puo' essere utilizzato per produrre energia. L'ammoniaca derivante dalla deaminazione degli aminoacidi e' tossica e non puo' essere usata per produrre energia; viene invece convertita in urea nel ciclo omonimo ed eliminata con le urine. La deaminazione degli aminoacidi e' possibile in modo diretto per l'acido glutamico, ad opera dell'enzima glutamico deidrogenasi (e in minor misura, per molti aminoacidi dalle aminoacido ossidasi):
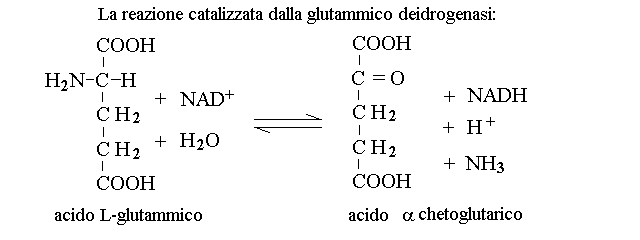
Nel caso degli aminoacidi diversi dall'acido glutamico il meccanismo piu' comune di deaminazione avviene in due passaggi: prima una amino transferasi specifica trasferisce il gruppo aminico dall'aminoacido in questione all'acido α - chetoglutarico (un metabolita del ciclo di Krebs); i prodotti di questa reazione sono il chetoacido corrispondente all'aminoacido e l'acido glutamico. Nel secondo passaggio l'acido glutamico prodotto viene deaminato dalla glutamico deidrogenasi. Riporto a titolo di esempio la reazione di transaminazione dell'alanina ad acido piruvico:
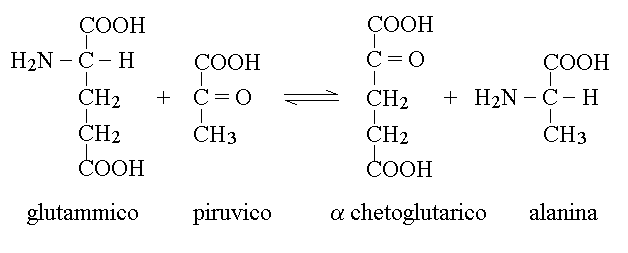
In ogni caso, alla fine di questo processo i prodotti sono α - chetoacidi e ammoniaca. L'ammoniaca viene convertita in urea, mentre i chetoacidi vengono convertiti in metaboliti della glicolisi o del ciclo di Krebs ed utilizzati per produrre energia.
IL CICLO DELL'UREA. Il ciclo dell'urea e' un percorso catabolico dissimilatorio, il cui fine non e' produrre energia ma utilizzare l'ammoniaca prodotta nel corso del metabolismo degli aminoacidi per sintetizzare l'urea, molecola che viene finalmente escreta nelle urine. Tutti gli animali assorbono con la dieta aminoacidi in eccesso rispetto al loro fabbisogno; questi vengono deaminati, trasformati in acetil-CoA ed avviati al ciclo di Krebs. L'ammoniaca derivante dalla deaminazione degli aminoacidi e' tossica e deve essere eliminata. I pesci producono una urina diluita e possono eliminare l'ammoniaca come tale; i vertebrati terrestri invece concentrano l'urina ad un livello al quale l'ammoniaca sarebbe dannosa per il tessuto renale e debbono quindi convertire questa molecola in altre molecole meno tossiche (urea per i mammiferi, acido urico per gli uccelli) prima di eliminarla.
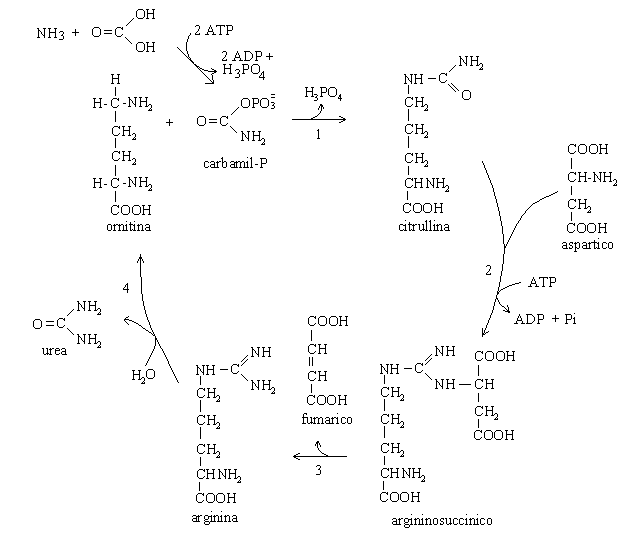
Il ciclo dell'urea inizia con la biosintesi del carbamil-fosfato a partire da ammoniaca e bicarbonato; la reazione, catalizzata dalla carbamilfosfato sintetasi consuma due molecole di ATP. L'enzima ornitina carbamil transferasi combina tra loro una molecola di ornitina e una di carbamilfosfato per sintetizzarne una di citrullina (reazione 1; ornitina e citrullina sono due aminoacidi non proteici). La argininsuccinato sintetasi utilizza citrullina e acido aspartico (un aminoacido proteico) per produrre acido argininosuccinico, con consumo di ATP (reazione 2). L'arigininosuccinato liasi rompe l'acido argininosuccinico per produrre acido fumarico e arginina (altro aminoacido proteico; reazione 3); ed infine l'arginasi degrada l'arginina in ornitina ed urea. L'urea viene escreta mentre l'ornitina puo' essere utilizzata in un nuovo ciclo.
Il bilancio complessivo del ciclo dell'urea e' il seguente:
NH3 + H2CO3 + COOH-CH2-CHNH2-COOH --> CO(NH2)2 + COOH-CH=CH-COOH + 2 H2O
I due atomi di azoto della molecola di urea vengono uno dall'ammoniaca ed uno dall'acido aspartico. Inoltre e' possibile convertire l'acido fumarico prodotto nel ciclo in acido ossalacetico (ultime reazioni del ciclo di Krebs) e poi quest'ultimo di nuovo in acido aspartico (mediante transaminazione).
CATABOLISMO DEI RESIDUI DEGLI AMINOACIDI. Il chetoacido che risulta dalla deaminazione dell'aminoacido puo' essere convertito in uno zucchero o suo derivato (aminoacidi "glicogenici" o in un acido grasso o suo derivato (aminoacidi "lipogenici"). La maggioranza degli aminoacidi e' glicogenica: ad esempio la deaminazione dell'alanina produce acido piruvico (cfr. glicolisi), quella dell'acido glutammico acido ossalacetico (cfr. ciclo di Krebs); quella dell'acido aspartico acido ossalacetico (cfr. ciclo di Krebs); etc. Pochi aminoacidi sono lipogenici: ad es. leucina e lisina. In genere le vie cataboliche e le transaminazioni sono reversibili e quindi consentono non soltanto la degradazione ma anche la biosintesi degli aminoacidi, se necessaria all'organismo. Nelle proteine sono presenti 20 aminoacidi diversi, e ciascuno ha un suo specifico catabolismo, come riassunto nella seguente tabella:
| Aminoacidi | metabolita terminale |
| Glicina | anidride carbonica e ammoniaca |
| (Glicina,) Alanina, Serina, Treonina, Cisteina | acido piruvico |
| Metionina | Cisteina + propionil-CoA -> acido piruvico |
| Acido aspartico, asparagina | acido ossalacetico (ciclo di Krebs) -> ac. piruvico |
| Acido glutamico, glutamina | acido alfa chetoglutarico (ciclo di Krebs) -> ac. ossalacetico |
| Arginina, Prolina, Istidina | acido glutamico -> alfa chetoglutarico (ciclo di Krebs) -> ac. ossalacetico |
| Lisina | acetil-CoA (ciclo di Krebs) + ac. acetoacetico |
| Valina, Isoleucina | propionil-CoA (ciclo di Krebs) |
| Leucina | acetil-CoA (ciclo di Krebs) + ac. acetoacetico |
| Fenilalanina, Tirosina | acetil-CoA (ciclo di Krebs) + ac. acetoacetico |
| Triptofano | alanina + ac. acetil-CoA (ciclo di Krebs) |
A titolo di esempio vengono riportati di seguito esempi del catabolismo degli aminoacidi piu' comuni.
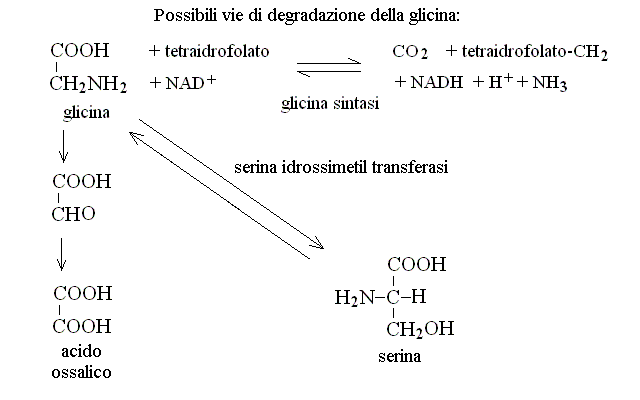
CATABOLISMO DELLA GLICINA. La glicina puo' essere metabolizzata attraverso tre percorsi metabolici distinti: transaminazione ad acido gliossalico (che viene ossidato ad ac. ossalico ed escreto nelle urine); scomposizione in bicarbonato, ammoniaca ed un gruppo metilenico (legato al coenzima tetraidrofolato); idrossimetilazione a serina (sul quale aminoacido vedi oltre):
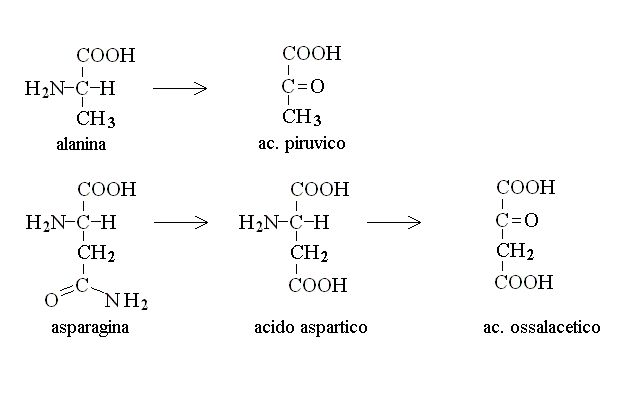
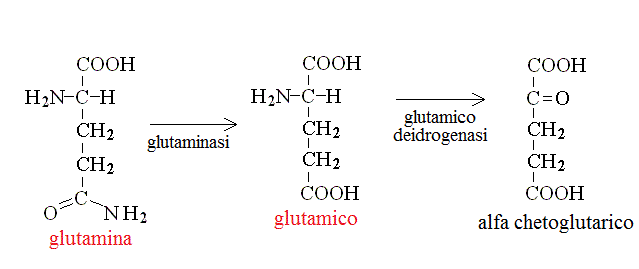
CATABOLISMO DI ALANINA, ASPARAGINA, AC. ASPARTICO, GLUTAMINA ED AC. GLUTAMICO. I chetoacidi derivanti da questi aminoacidi sono metaboliti adatti per il ciclo di Krebs: infatti dall'alanina si ottiene ac. piruvico, da asparagina ed aspartico ac. ossalacetico, da glutamina e ac. glutamico ac. α - chetoglutarico:
 |
 |
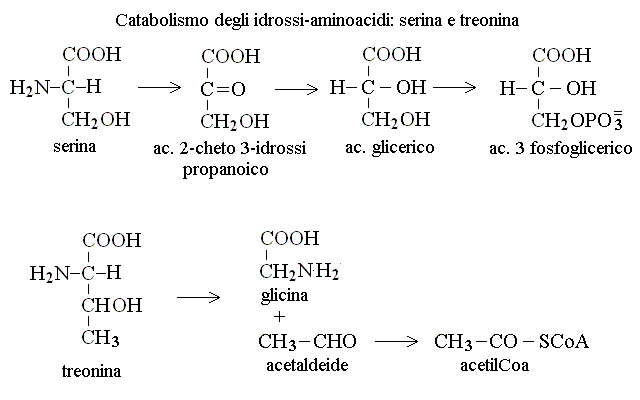
CATABOLISMO DI SERINA E TREONINA. I chetoacidi che derivano dagli aminoacidi contenenti il gruppo OH sono cheto- idrossi- acidi ed hanno un metabolismo particolare. Dalla serina si ottiene ac. 3-idrossi 2-cheto propanoico che viene ridotto ad ac. glicerico e fosforilato con consumo di ATP ad ac. 3 fosfoglicerico; di qui in poi si segue il percorso della glicolisi fino all'ac. piruvico. La treonina non viene deaminata ma viene invece scissa in glicina e acetaldeide; quest'ultima viene ossidata ad acetil-CoA ed introdotta nel ciclo di Krebs:
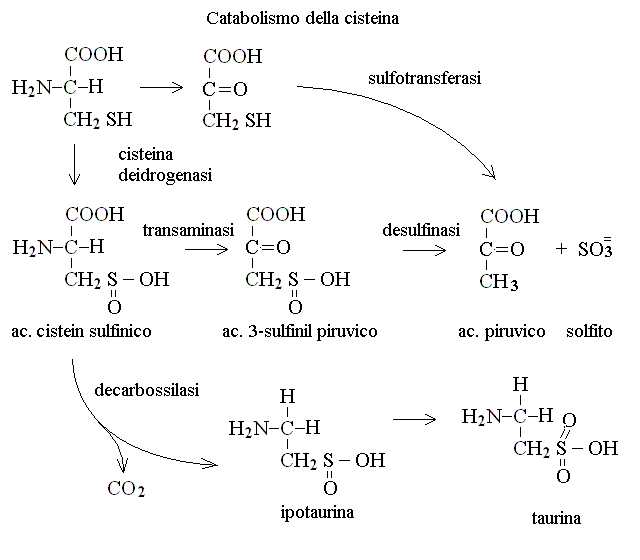
CATABOLISMO DELLA CISTEINA. La cisteina puo' venire degradata per tre vie, due delle quali portano all'ac. piruvico con eliminazione di ac. solfidrico o di ac. solforoso; la terza porta invece alla sintesi della taurina un metabolita necessario ad alcuni tessuti (tra i quali il sistema nervoso centrale):
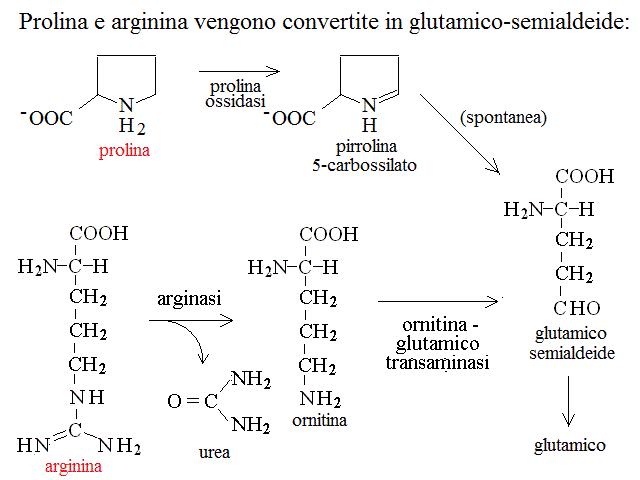
CATABOLISMO DELL'ARGININA. L'arginina viene degradata dall'arginasi a urea e ornitina (si veda la formula di questo composto nello schema del ciclo dell'urea); l'ornitina, se non necessaria per il ciclo dell'urea puo' essere transaminata e ossidata fino ad ac. glutamico e poi ad α - chetoglutarico.
CATABOLISMO DELLA PROLINA. Anche la prolina, come l'arginina e l'istidina viene convertita in glutamico. In questo caso il metabolita intermedio e' un un derivato del pirrolo, la pirrolina-5-carbossilato:
CATABOLISMO DELL'ISTIDINA. L'istidina viene convertita in acido glutamico passando per un metabolita intermedio caratteristico, chimato acido urocanico:
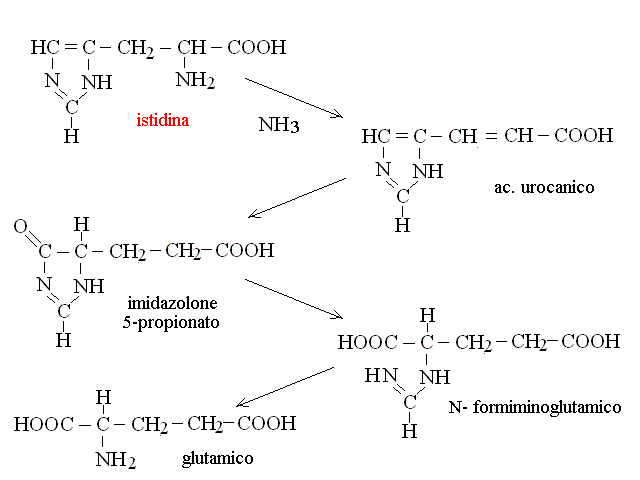
CATABOLISMO DELLA LISINA: richiede una molecola di acido glutamico e costituisce la via metabolica della saccaropina:
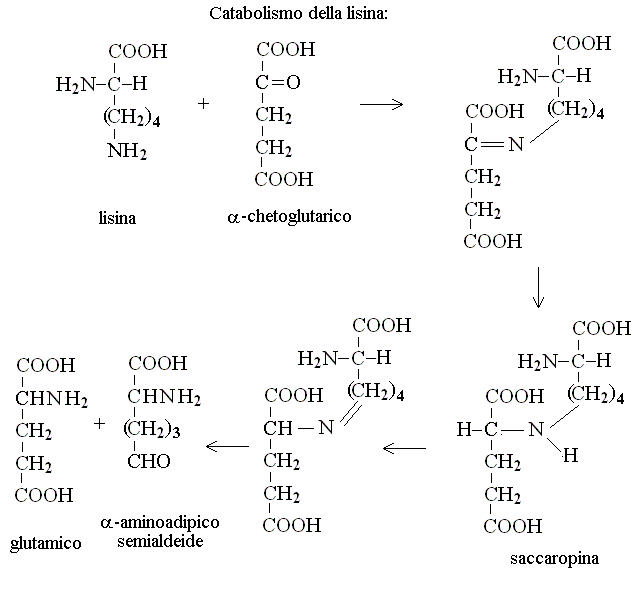
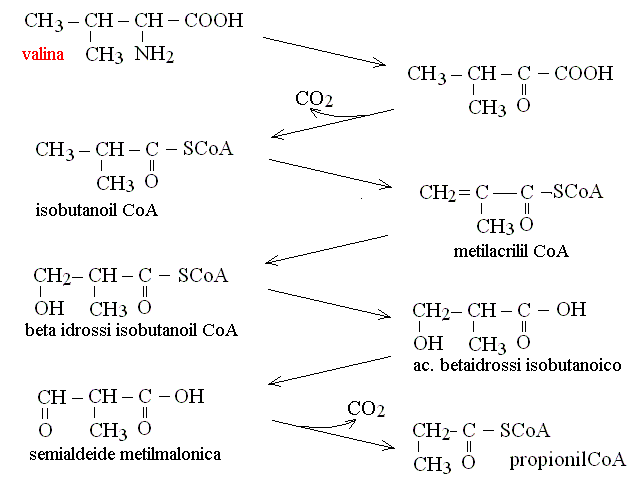
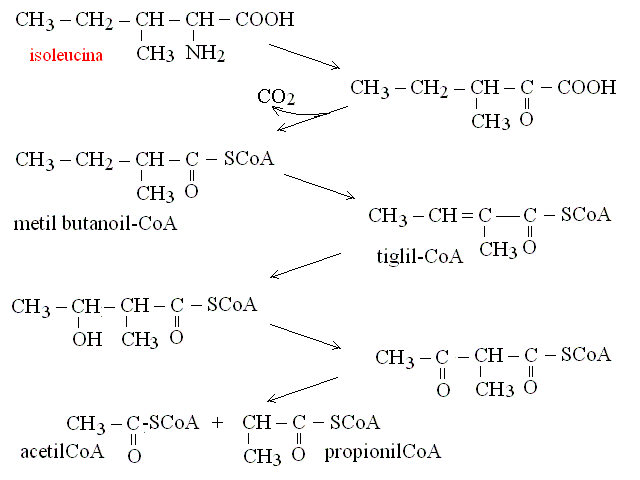
CATABOLISMO DEGLI AMINACIDI RAMIFICATI: VALINA, LEUCINA, ISOLEUCINA. Lo scheletro carbonioso degli aminoacidi ramificati non puo' essere facilmente inserito nelle vie metaboliche usuali (glicolisi, ciclo di Krebs); il metabolismo di questi aminoacidi richiede una serie di decarbossilazioni, isomerizzazioni e rotture della molecola che rimuovano le ramificazioni. I prodotti finali del metabolismo di questi aminoacidi sono acetil-CoA o propionil-CoA:
 |
 |
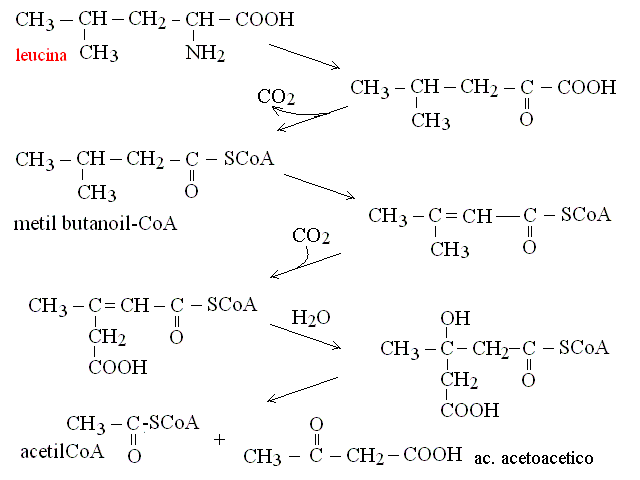 |
CATABOLISMO DEGLI AMINOACIDI AROMATICI. Il metabolismo del triptofano e' complesso e forma inizialmente la kinurenina; questa viene convertita in un derivato dell'acido antranilico e poi in carbossimuconato semialdeide. Dalla carbossimuconato semialdeide e' possibile ottenere l'acido chinolinico, un precursore della nicotinamide; la via biosintetica pero' e' inefficiente e pertanto insufficiente ai fabbisogni dell'organismo: per questo la nicotinamide è una vitamina, che deve essere fornita dalla dieta. In massima parte la carbossimuconato semialdeide viene convertita in ac.alfa-chetoadipico e quest'ultimo in acetil-CoA (cfr. catabolismo della Lisina).
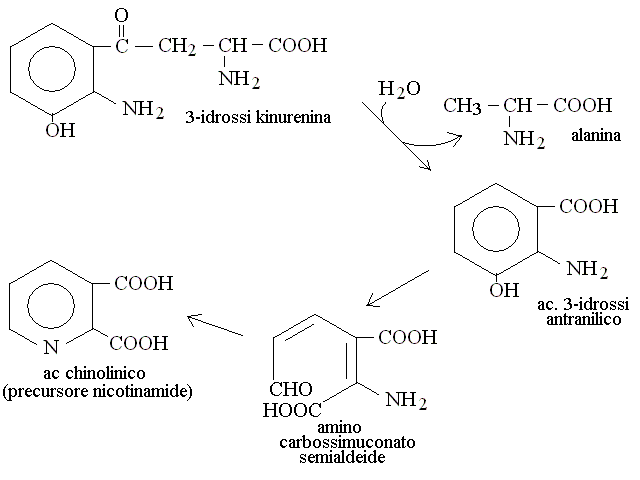 |
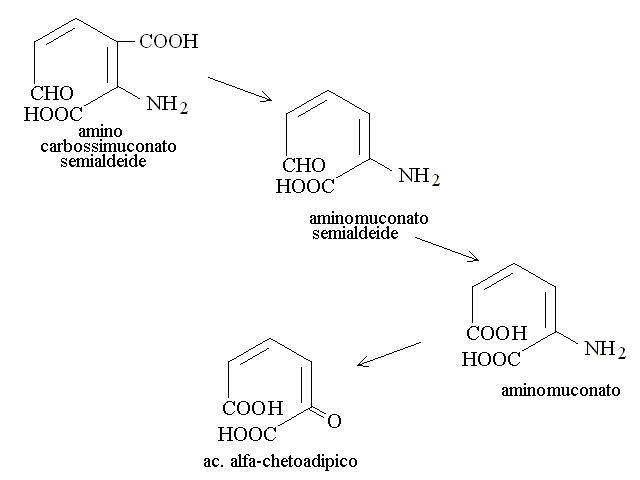 |
Tirosina e fenilalanina devono essere considerate insieme in quanto l'una puo' essere convertita nell'altra e viceversa. La tirosina viene quindi convertita in ac. fumarico (un metabolita del ciclo di Krebs) e in acido acetoacetico (che poi viene trasformato in due molecole di acetil-CoA). Due metaboliti importanti di questa via metabolica sono l'ac. fenilpiruvico e l'ac. omogentisico
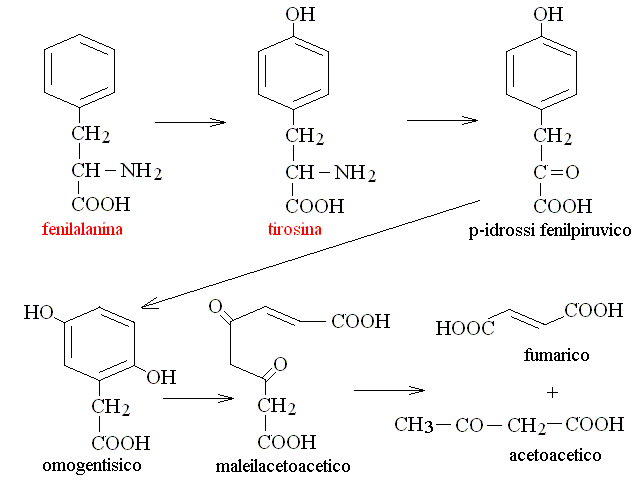
CATABOLISMO DELLA METIONINA: e' peculiare in quanto passa per la produzione di S-adenosil-metionina, un coenzima che agisce come donatore/trasportatore di gruppi metilici. La S-adenosil-metionina puo' poi essere degradata separandone i componenti e restituisce omocisteina. L'omocisteina, combinandosi con una molecola di serina restituisce l'aminoacido non proteico cistationina, che viene scomposto in cisteina e propionil-CoA.
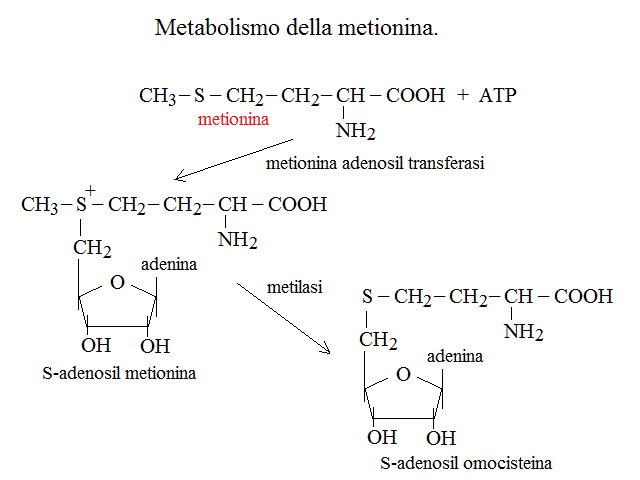 |
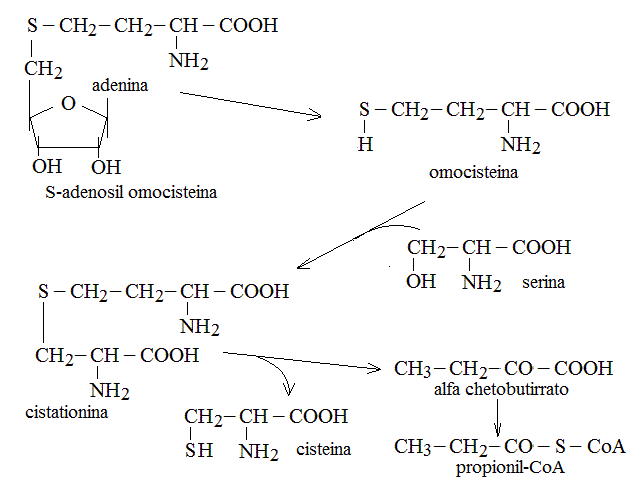 |
SOMMARIO: IL CATABOLISMO DEGLI AMINOACIDI.
Quando la dieta contiene un eccesso di aminoacidi, o in condizioni di denutrizione, nelle quali si ha riassorbimento di proteine strutturali (spec. actomiosina dal tessuto muscolare), tutti gli aminoacidi possono essere degradati per produrre energia, attraverso il ciclo di Krebs, o per produrre glucosio, attraverso la gliconeogenesi. La maggioranza degli aminoacidi va incontro a trasformazioni che, dopo deaminazione, convertono la struttura carboniosa della molecola in ossalacetato/piruvato (poiche' queste due molecole sono tra loro interconvertibili grazie agli enzimi piruvato carbossilasi e fosfoenolpiruvato carbossichinasi non ha senso tenerle distinte). Tutti gli aminoacidi dalla cui degradazione e' possibile ottenere ossalacetato/piruvato sono definiti glicogenici in quanto da ossalacetato/piruvato si puo' ottenere glucosio mediante la gliconeogenesi. Soltanto due aminoacidi, lisina e leucina, vengono convertiti ad acetil-CoA senza passare per la coppia ossalacetato/piruvato: questi sono chiamati lipogenici, perche' l'acetil-CoA, oltre a poter entrare nel ciclo di Krebs, puo' essere usato per la biosintesi dei lipidi, essendo il precursore sia degli acidi grassi che del colesterolo. Cinque aminoacidi, che includono i tre aromatici (tirosina, fenilalanina e triptofano) sono sia lipogenici che glicogenici in quanto dalla loro degradazione si ottiene sia acetil-CoA che ossalacetato/piruvato. E' importante considerare a parte il caso degli aminoacidi che vengono convertiti in propionil-CoA (valina, metionina, isoleucina): questa molecola infatti viene convertita in succinil-CoA e poi in ossalacetato nel ciclo di Krebs. Come conseguenza, anche se formalmente il propionil-CoA e' un metabolita degli acidi grassi (se a catena dispari di atomi di carbonio), funzionalmente e' un composto della serie glicogenica.
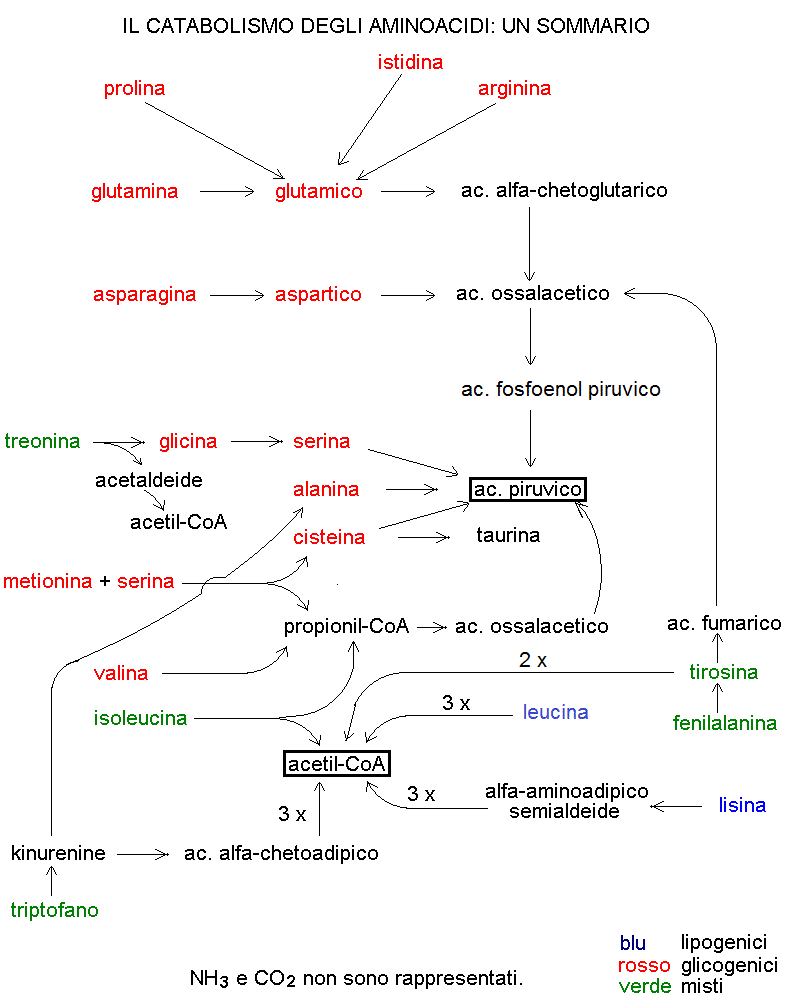
Per quale motivo si da tanta importanza alla natura glicogenica o lipogenica di un metabolita? Come e' spiegato qui sotto, i composti lipogenici non possono produrre altro che lipidi (o essere bruciati nel ciclo di Krebs); i composti glicogenici invece possono essere usati per produrre sia lipidi che glicidi che altri aminoacidi ed hanno quindi un valore nutrizionale maggiore. Inoltre alcuni organi, primo tra tutti il cervello usano esclusivamente o prevalentemente glicidi per il loro metabolismo energetico e non possono essere nutriti con lipidi o con sostanze lipogeniche.
CONSIDERAZIONI CONCLUSIVE SUL CATABOLISMO. Il catabolismo dei nutrienti finalizzato alla produzione di energia avviene principalmente attraverso il ciclo di Krebs, il quale richiede come metaboliti iniziali ac. ossalacetico e acetil-CoA. Gli zuccheri possono produrre entrambe queste sostanze: l'ac. ossalacetico grazie alla piruvico carbossilasi, l'acetil-CoA grazie alla piruvico deidrogenasi (o decarbossilasi). Gli acidi grassi producono soltanto acetil-CoA e quindi non possono essere ossidati in assenza di una qualche sorgente di ac. ossalacetico (anche in minima quantita'), necessaria a compensare le eventuali sottrazioni di metaboliti del ciclo (ad es. di ac. α - chetoglutarico). Gli aminoacidi, una volta deaminati possono produrre acetil-CoA e varie possibili sorgenti di ac. ossalacetico (piruvico, ossalacetico, α - chetoglutarico, etc.). Le relazioni tra questi percorsi metabolici si possono schematizzare come segue:
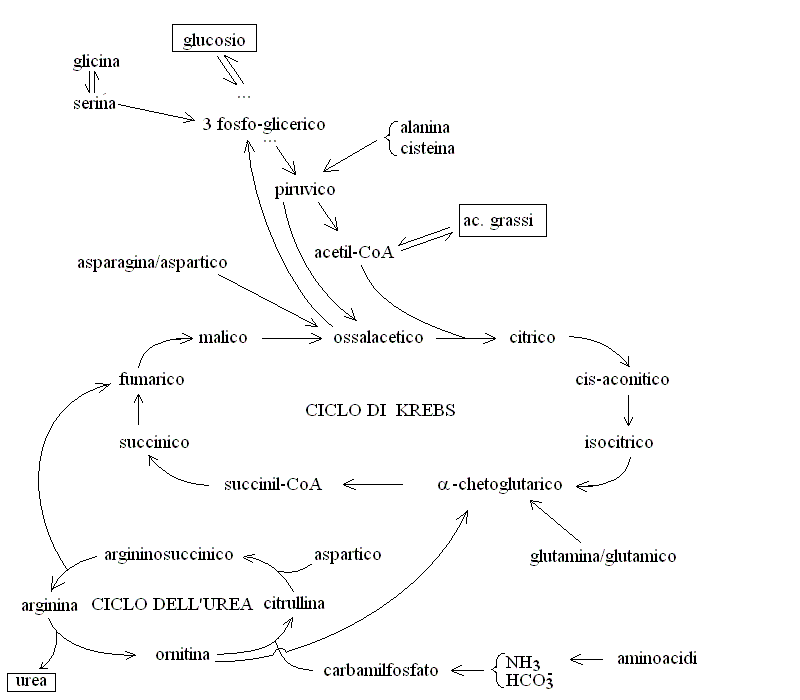
E' molto importante considerare quali percorsi catabolici siano reversibili e quali irreversibili: infatti la reversibilita' condiziona la possibilita' di convertire un metabolita in un altro e un nutriente in un altro. Si osserva in questo schema che i lipidi sono metaboliti "poveri" che possono essere usati per produrre energia (come acetil-CoA) ma non possono essere usati per la biosintesi di nient'altro: infatti non esiste nell'organismo umano una acetil-CoA carbossilasi che possa convertire questo metabolita in ac. piruvico. Pertanto non e' possibile utilizzare le nostre riserve di grasso per produrre zuccheri o aminoacidi. Per contro gli zuccheri e gli aminoacidi possono spesso essere interconvertiti tra loro (la reazione delle transaminasi e' infatti reversibile) ed entrambi possono essere convertiti in acetil-CoA ed acidi grassi.
Il metabolismo degli acidi nucleici e' complesso e deve essere distinto in due gruppi di reazioni tra loro molto diverse: la biosintesi e degradazione dei nucleotidi e la biosintesi degradazione e funzione biologica dei polinucleotidi.
Acidi nucleici sono introdotti nell'organismo con gli alimenti ma soltanto in quantita' modeste rispetto a quelle degli altri nutrienti. Sono depolimerizzati e trasfromati in singoli nucleotidi dagli enzimi RNAsi, DNAsi e polinucleotidasi prodotti dal pancreas e dall'intestino e i nucleotidi monofosfati, nucleosidi e basi azotate libere possono essere assorbite. Il fegato e gli altri tessuti sono capaci di reazioni di recupero delle basi azotate, che vengono nuovamente combinate con il ribosio (sotto forma di fosforibosil pirofosfato) ed utilizzate per la biosintesi dei polimeri; alternativamente le basi azotate vengono degradate ed eliminate: le basi puriniche sono trasformate in urato, le pirimidiniche in β - alanina o acido β - isobutanoico, secondo gli schemi di reazione seguenti:
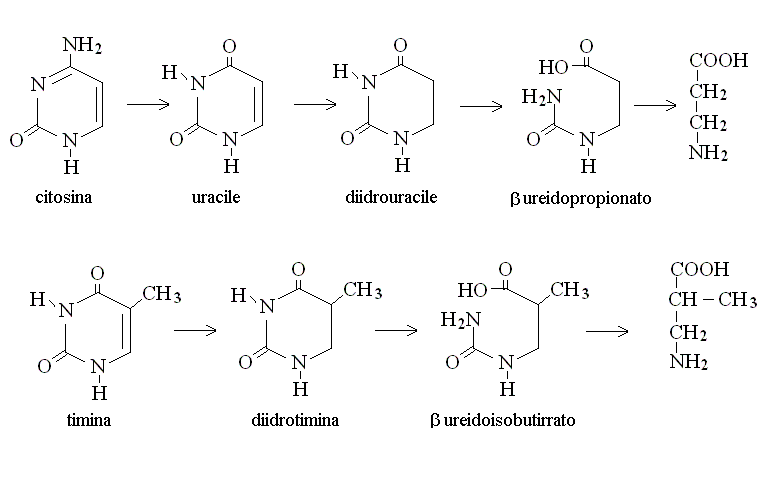
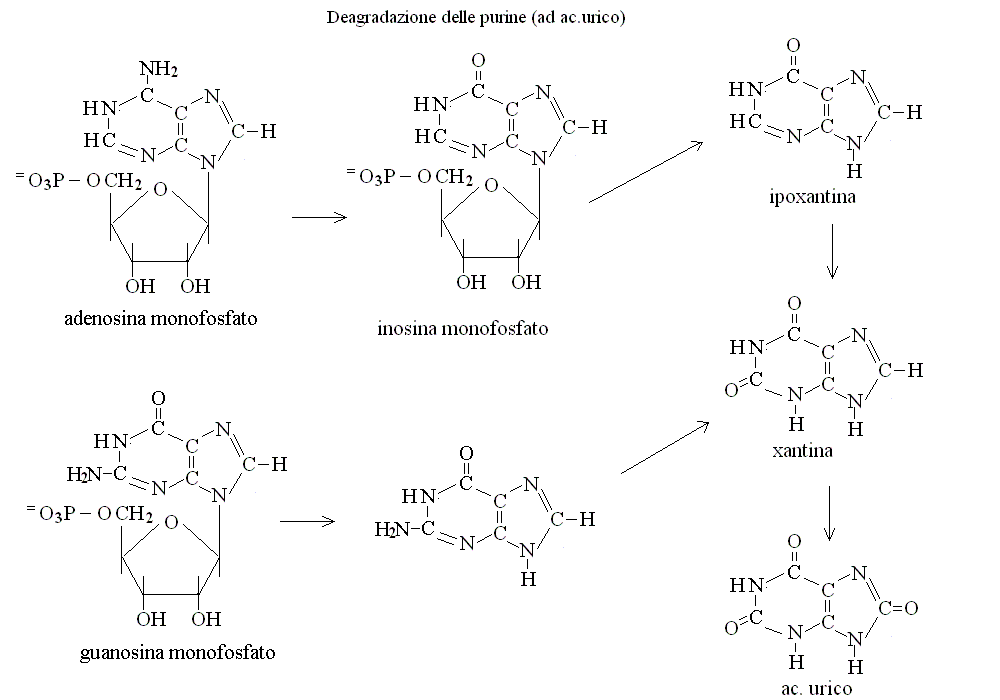
LA BIOSINTESI DELLE PIRIMIDINE costituisce un esempio di percorso anabolico, finalizzato alla biosintesi di molecole necessarie alla cellula (le basi pirimidiniche del DNA e dello RNA).
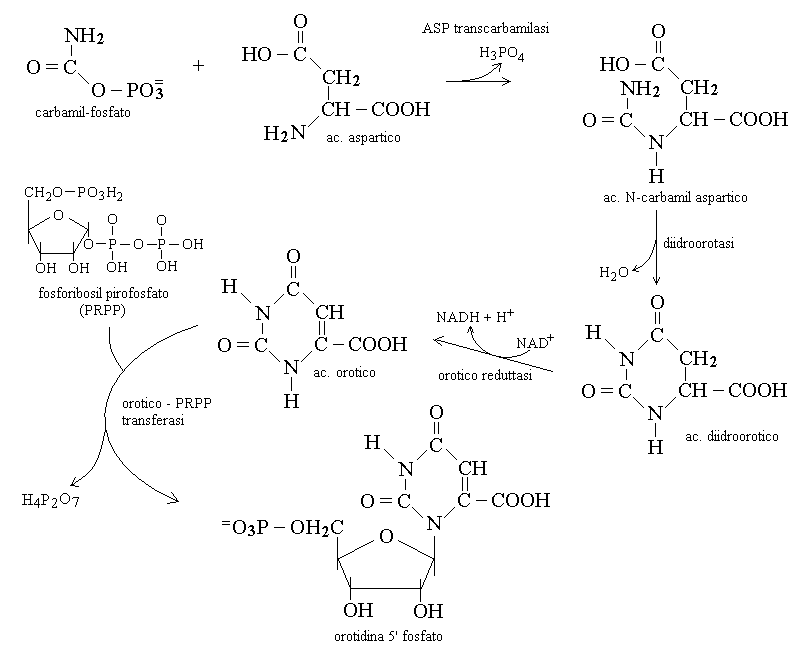
Il ciclo inizia, come quello dell'urea, con la biosintesi del carbamil fosfato; quest'ultimo viene poi combinato con l'acido aspartico per formare acido N-carbamil aspartico; l'enzima e' l'aspartico transcarbamilasi. La deidrogenazione dell'acido N-carbamil aspartico ad opera dell'enzima diidroorotasi produce l'acido diidroorotico, il metabolita successivo. La riduzione dell'acido diidroorotico produce l'acido orotico; l'enzima necessario si chiama orotico reduttasi ed utilizza come cofattore il NAD+. L'acido orotico e' gia' una base pirimidinica e viene combinato con il fosforibosil pirofosfato (PRPP) per formare il nucleotide corrispondente, orotidina 5' fosfato; l'enzima e' la orotico-PRPP transferasi e la reazione rilascia una molecola di acido pirofosforico (H4P2O7) che in acqua si scinde in due molecole di acido fosforico.
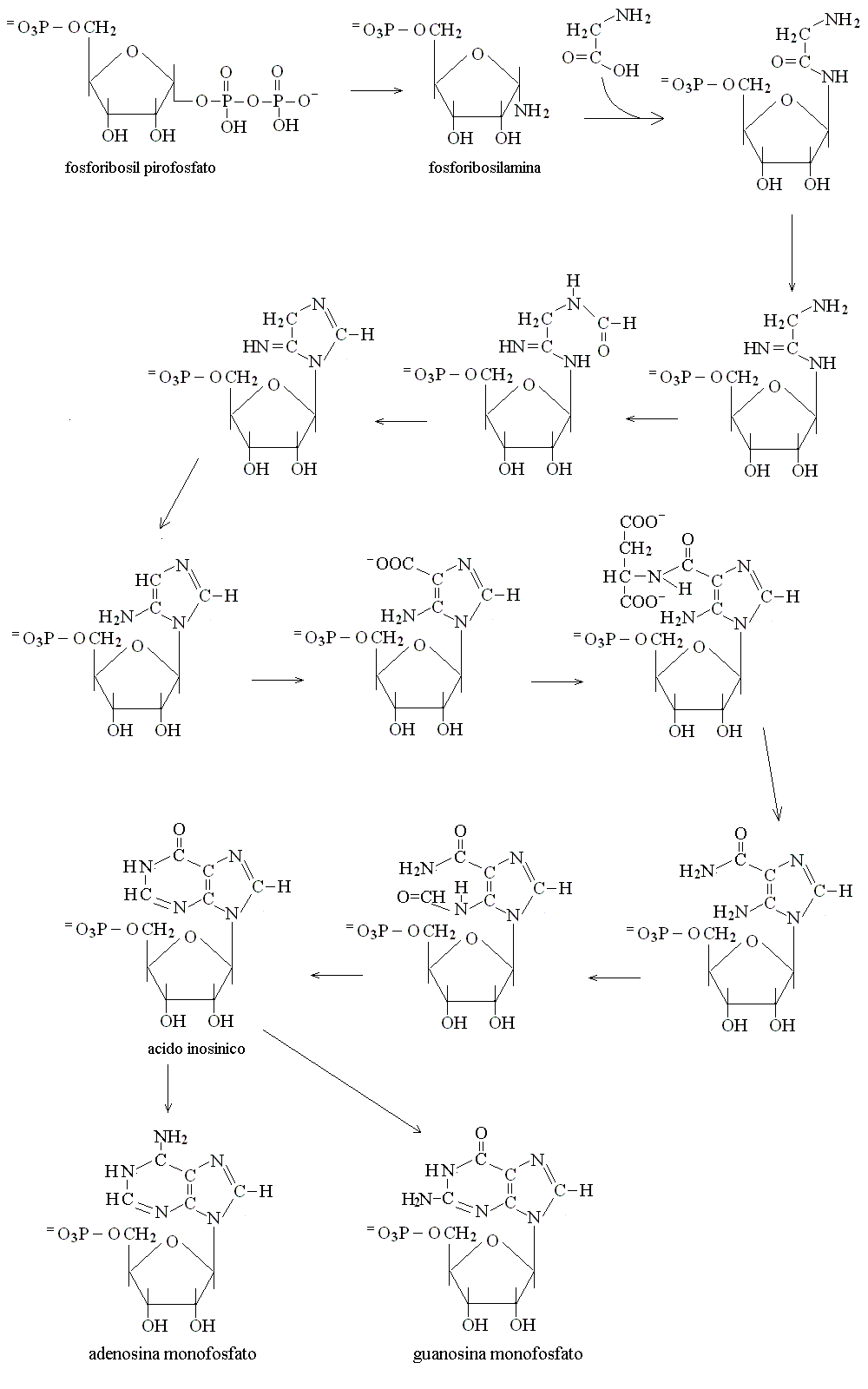
LA BIOSINTESI DELLE PURINE avviene per aggiunta di singoli atomi o piccoli gruppi di atomi ed e' una via piuttosto complessa ed energeticamente costosa:
Torna a: didattica; pagina iniziale.