FACOLTA' DI FARMACIA E MEDICINA - CLUPS DIETISTA
SAPIENZA UNIVERSITA' DI ROMA
Gli aminoacidi sono estremamente importanti per la biologia e la medicina: oltre ad essere i monomeri che costituiscono le proteine, essi sono importanti sorgenti di nutrimento (sotto forma di proteine) e precursori di metaboliti ed ormoni indispensabili alla vita. Per questa ragione il metabolismo degli aminoacidi merita una attenzione particolare.
Gli aminoacidi proteici sono 20 (piu' alcune varianti modificate come l'idrossiprolina e l'idrossilisina presenti nel collageno): presentano tutti una struttura comune formata da un carbonio (chiamato il carbonio alfa) cui sono legati un gruppo carbossilico, un gruppo aminico, un atomo di idrogeno ed un residuo, unica parte variabile: presentano pertanto la formula generale R-CHNH2-COOH. Consegue che i 20 aminoacidi proteici (cui si devono aggiungere quelli non proteici) differiscono soltanto per il residuo R.
Dal punto di vista nutrizionale, la dieta fornisce proteine che subiscono nel nostro intestino un processo di digestione operato da vari enzimi


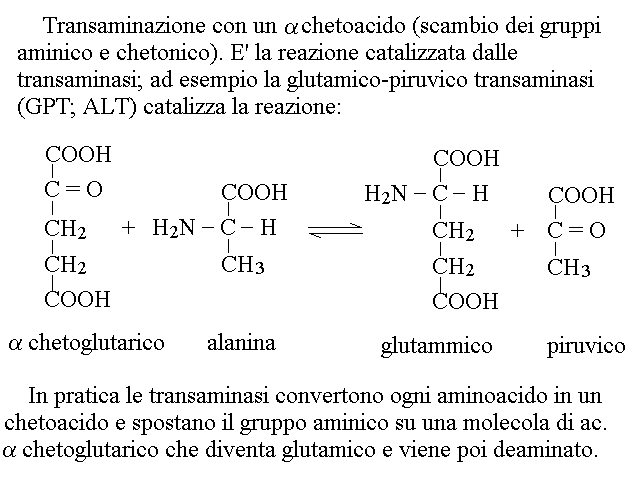


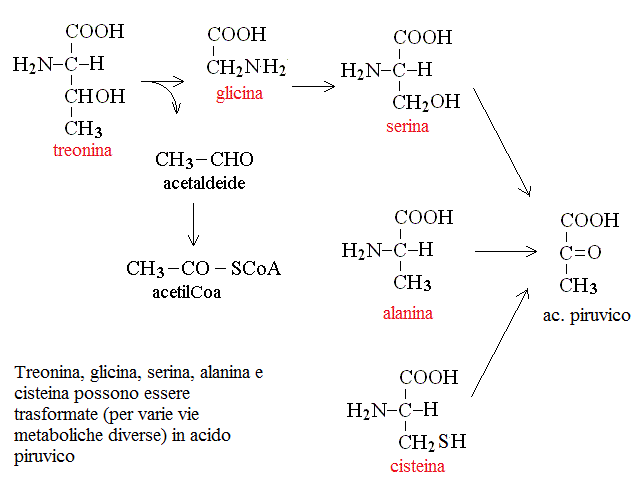




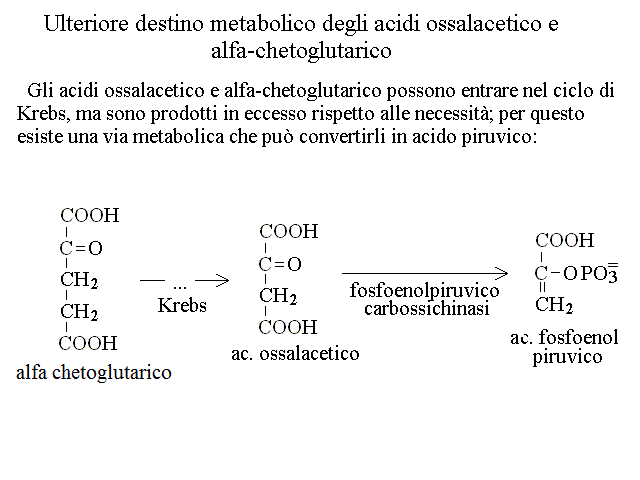


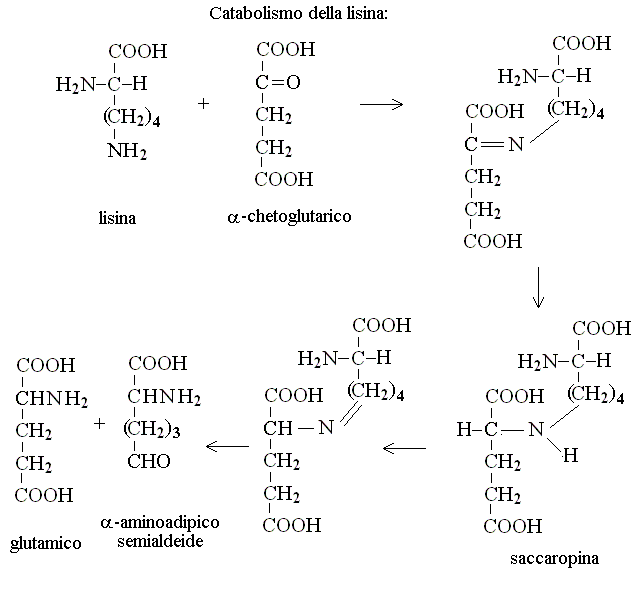

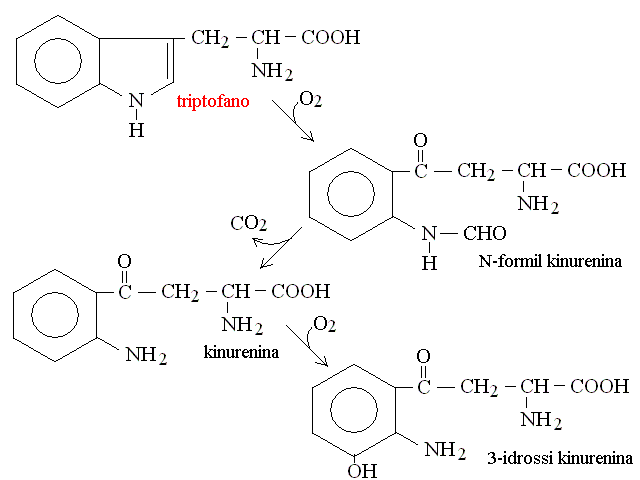
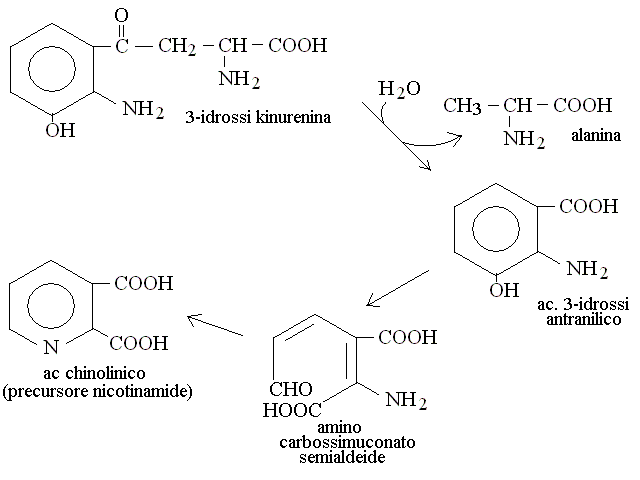
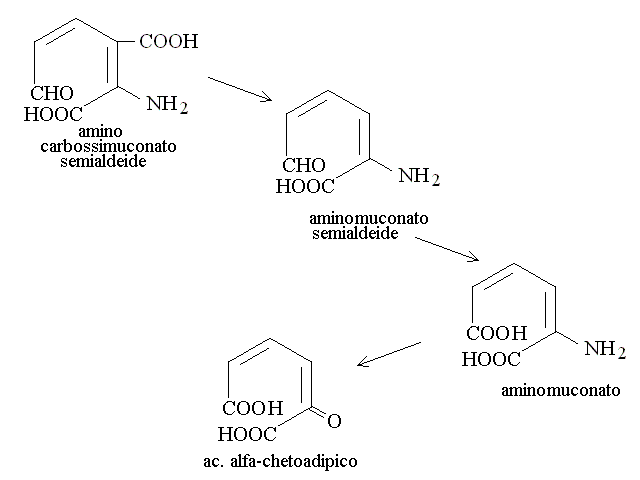

CATABOLISMO DEI RESIDUI DEGLI AMINOACIDI. Il chetoacido che risulta dalla deaminazione dell'aminoacido puo' essere convertito in uno zucchero o suo derivato (aminoacidi "glicogenici" o in un acido grasso o suo derivato (aminoacidi "lipogenici"). La maggioranza degli aminoacidi e' glicogenica: ad esempio la deaminazione dell'alanina produce acido piruvico (cfr. glicolisi), quella dell'acido glutammico acido ossalacetico (cfr. ciclo di Krebs); quella dell'acido aspartico acido ossalacetico (cfr. ciclo di Krebs); etc. Pochi aminoacidi sono lipogenici: ad es. leucina e lisina. In genere le vie cataboliche e le transaminazioni sono reversibili e quindi consentono non soltanto la degradazione ma anche la biosintesi degli aminoacidi, se necessaria all'organismo. Nelle proteine sono presenti 20 aminoacidi diversi, e ciascuno ha un suo specifico catabolismo, come riassunto nella seguente tabella:
| Aminoacidi | metabolita terminale |
| Glicina | anidride carbonica e ammoniaca |
| (Glicina,) Alanina, Serina, Treonina, Cisteina | acido piruvico |
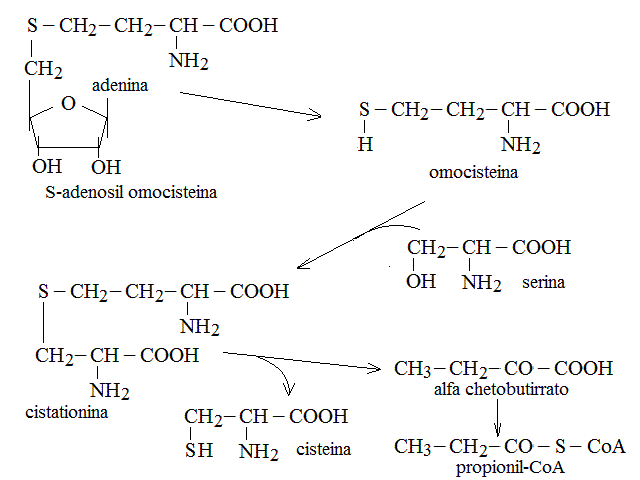
| Metionina | Cisteina + propionil-CoA -> acido piruvico |
| Acido aspartico, asparagina | acido ossalacetico (ciclo di Krebs) -> ac. piruvico |
| Acido glutamico, glutamina | acido alfa chetoglutarico (ciclo di Krebs) -> ac. ossalacetico |
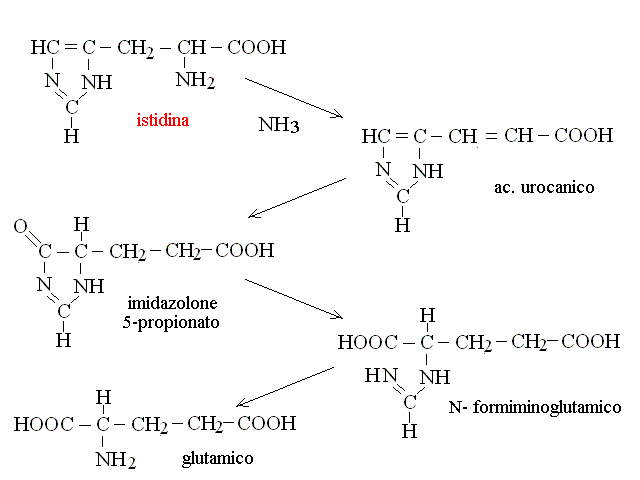
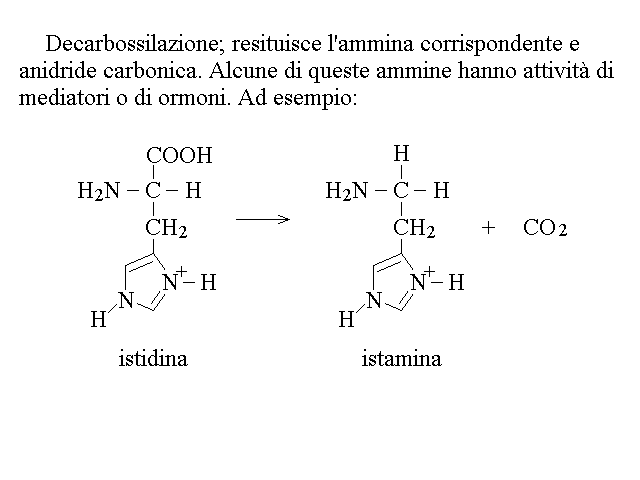
| Arginina, Prolina, Istidina | acido glutamico -> alfa chetoglutarico (ciclo di Krebs) -> ac. ossalacetico |
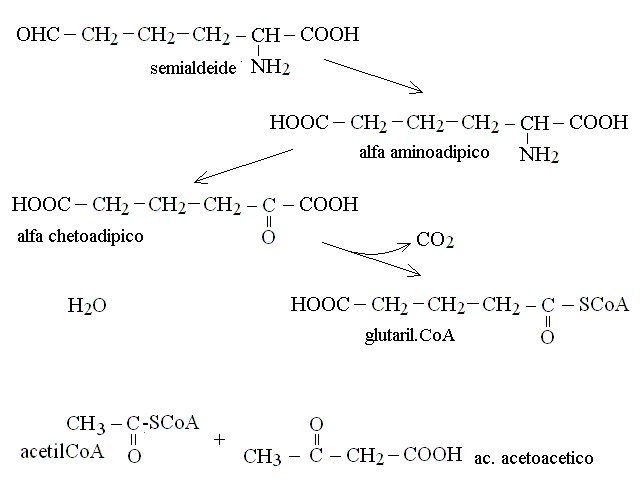
| Lisina | acetil-CoA (ciclo di Krebs) + ac. acetoacetico |
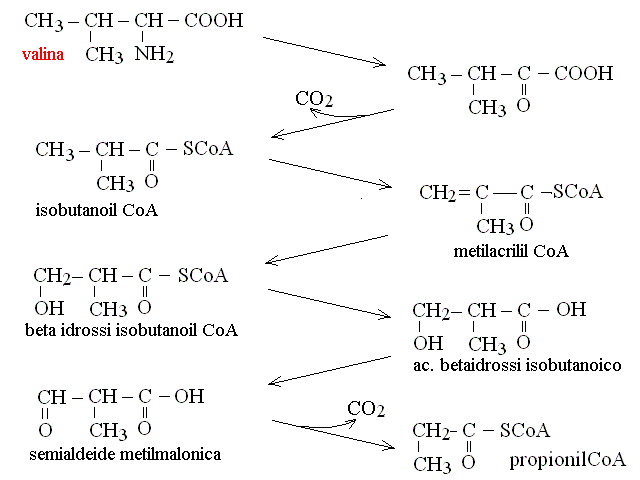
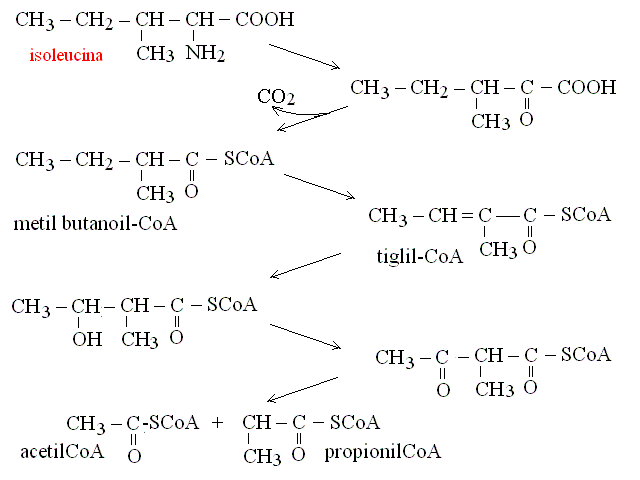
| Valina, Isoleucina | propionil-CoA (ciclo di Krebs) |
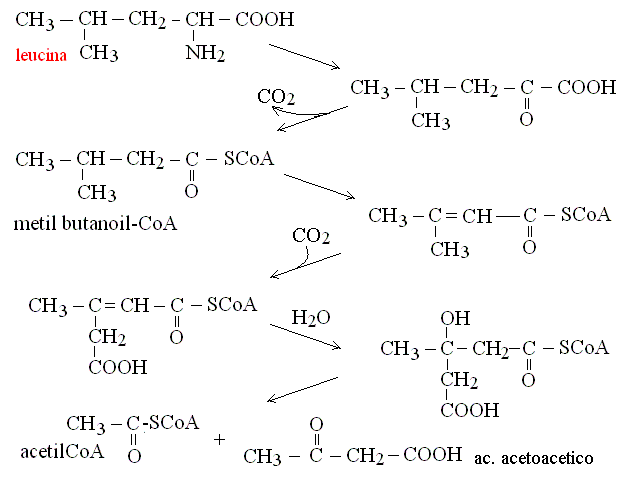
| Leucina | acetil-CoA (ciclo di Krebs) + ac. acetoacetico |
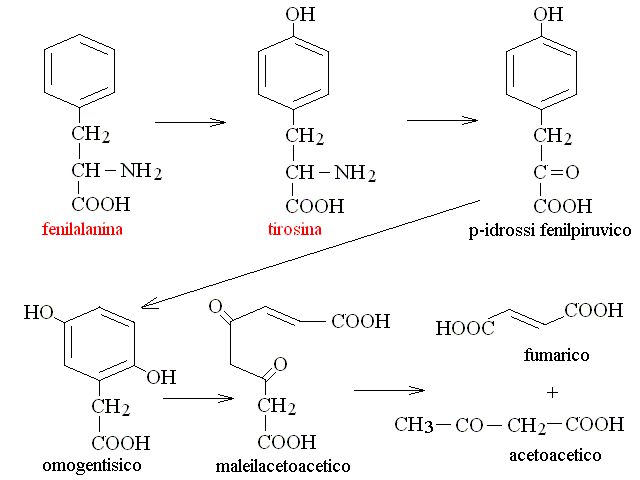
| Fenilalanina, Tirosina | acetil-CoA (ciclo di Krebs) + ac. acetoacetico |
| Triptofano | alanina + ac. acetil-CoA (ciclo di Krebs) |
A titolo di esempio vengono riportati di seguito esempi del catabolismo degli aminoacidi piu' comuni.
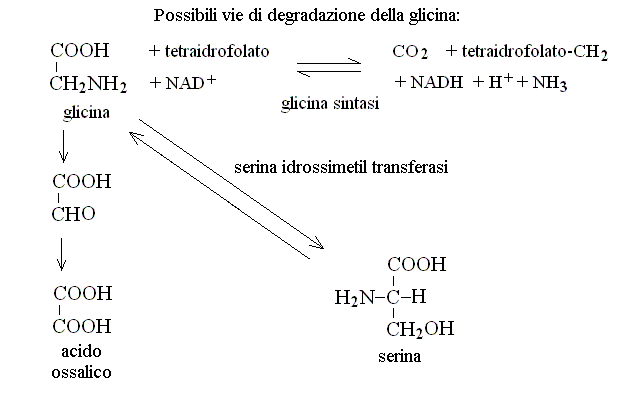
CATABOLISMO DELLA GLICINA. La glicina puo' essere metabolizzata attraverso tre percorsi metabolici distinti: transaminazione ad acido gliossalico (che viene ossidato ad ac. ossalico ed escreto nelle urine); scomposizione in bicarbonato, ammoniaca ed un gruppo metilenico (legato al coenzima tetraidrofolato); idrossimetilazione a serina (sul quale aminoacido vedi oltre):
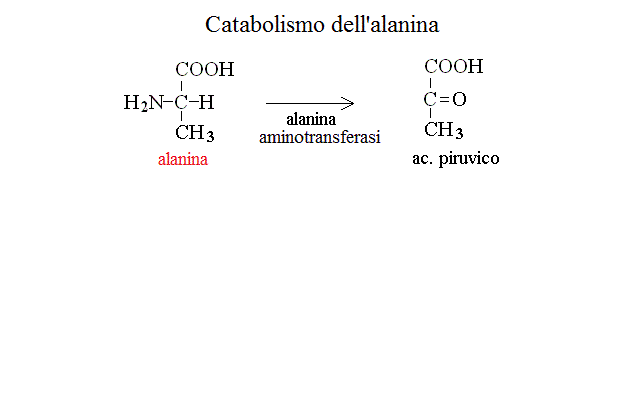
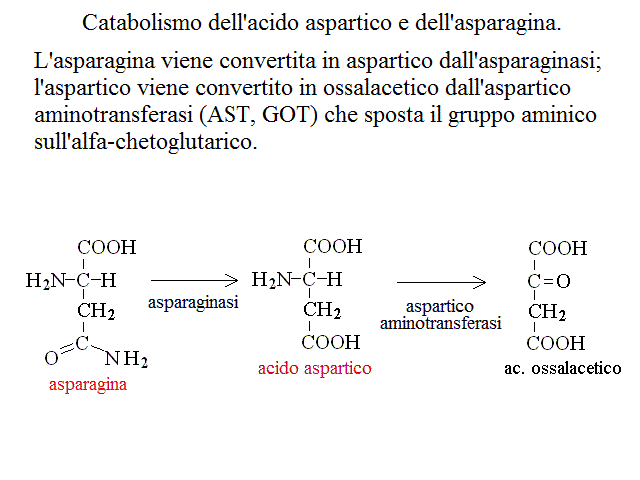
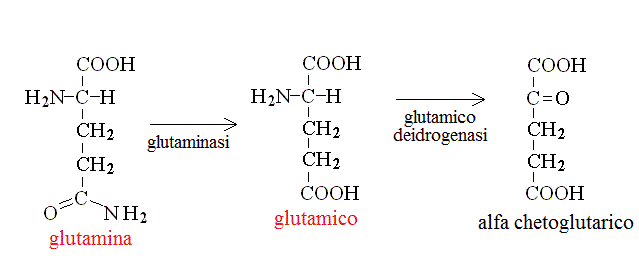
CATABOLISMO DI ALANINA, ASPARAGINA, AC. ASPARTICO, GLUTAMINA ED AC. GLUTAMICO. I chetoacidi derivanti da questi aminoacidi sono metaboliti adatti per il ciclo di Krebs: infatti dall'alanina si ottiene ac. piruvico, da asparagina ed asprtico ac. ossalacetico, da glutamina e ac. glutamico ac. α - chetoglutarico:
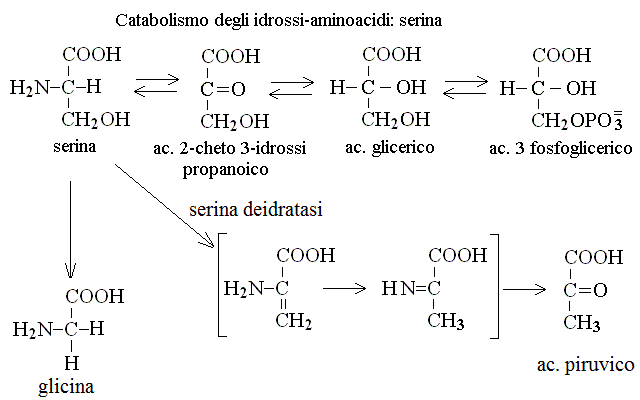
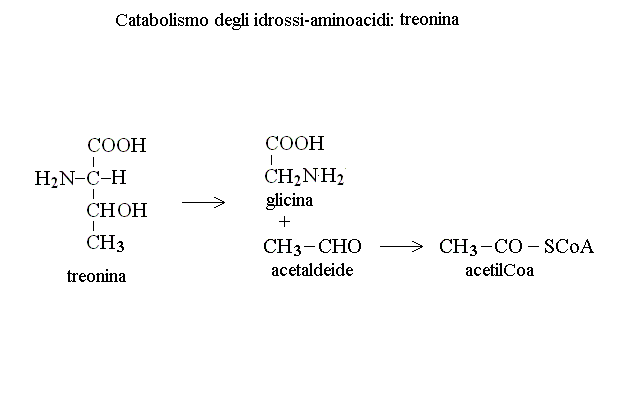
CATABOLISMO DI SERINA E TREONINA. I chetoacidi che derivano dagli aminoacidi contenenti il gruppo OH sono cheto- idrossi- acidi ed hanno un metabolismo particolare. Dalla serina si ottiene ac. 3-idrossi 2-cheto propanoico che viene ridotto ad ac. glicerico e fosforilato con consumo di ATP ad ac. 3 fosfoglicerico; di qui in poi si segue il percorso della glicolisi fino all'ac. piruvico. La treonina non viene deaminata ma viene invece scissa in glicina e acetaldeide; quest'ultima viene ossidata ad acetil-CoA ed introdotta nel ciclo di Krebs:
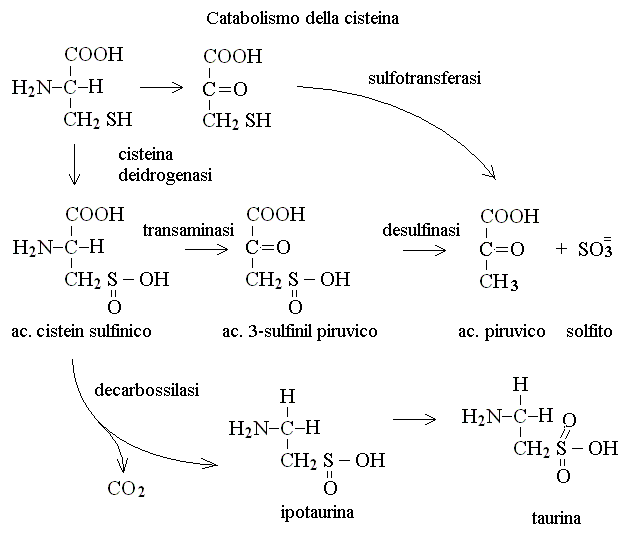
CATABOLISMO DELLA CISTEINA. La cisteina puo' venire degradata per tre vie, due delle quali portano all'ac. piruvico con eliminazione di ac. solfidrico o di ac. solforoso; la terza porta invece alla sintesi della taurina un metabolita necessario ad alcuni tessuti (tra i quali il sistema nervoso centrale):
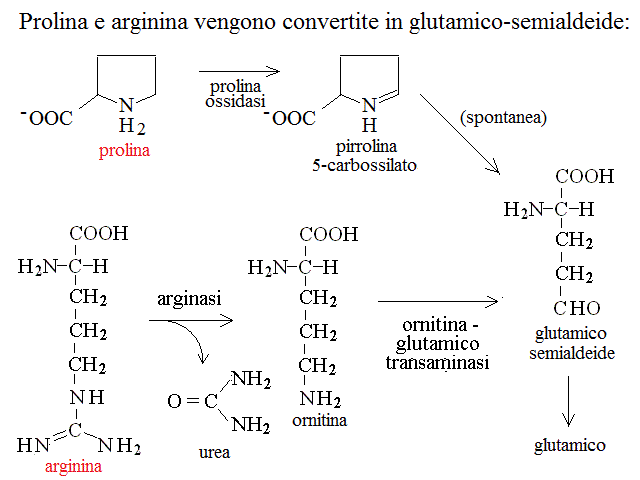
CATABOLISMO DELL'ARGININA. L'arginina viene degradata dall'arginasi a urea e ornitina; l'ornitina, se non necessaria per il ciclo dell'urea puo' essere transaminata e ossidata fino ad ac. α - chetoglutarico.
CATABOLISMO DELLA LISINA: richiede una molecola di acido glutamico e costituisce la via metabolica della saccaropina:
Le vitamine svolgono importanti funzioni nel metabolismo in quanto in genere sono i precursori di coenzimi, piccole molecole legate all'enzima e necessarie per l'azione catalitica. Non tutti gli enzimi utilizzano coenzimi ed e' raro che ciascun enzima ne utilizzi piu' di uno o due.
Le vitamine liposolubili sono 4: A, D, E e K. La vitamina A e' il composto chiamato retinolo ed ha due funzioni: nella forma dell'isomero 11 cis del retinale (stato ossidato del retinolo) e' il cofattore della proteina chiamata opsina che si trova nella retina ed e' necessaria per i fenomeni della visione.
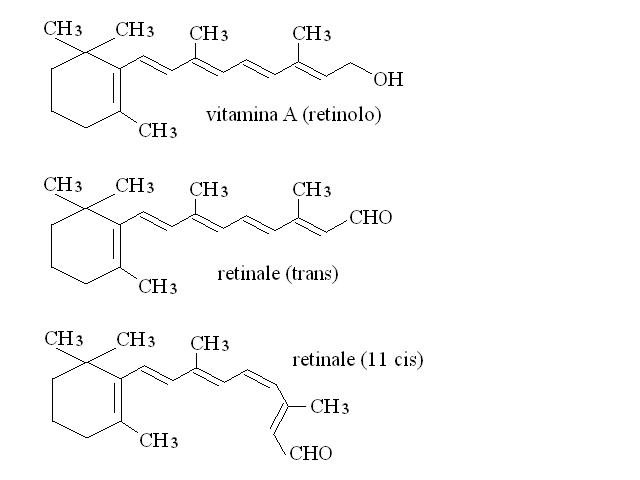
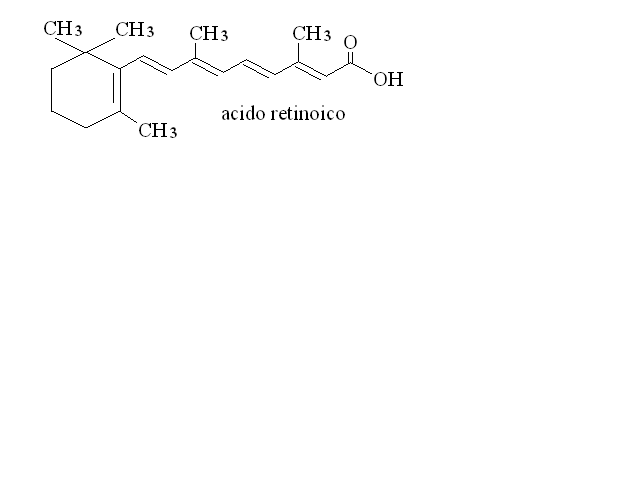
Nella forma ulteriormente ossidata dell'acido retinoico e' invece necessario per il differenziamento cellulare ed ha anche attivita' antineoplastica:
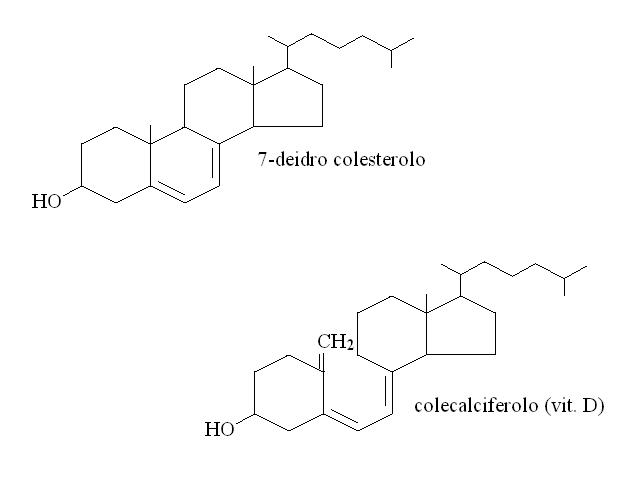
La vitamina D e' il composto chimico chiamato calciferolo. Puo' essere prodotto per irraggiamento solare del diidroergosterolo contenuto nel sottocutaneo. Partecipa al metabolismo del calcio e favorisce l'assorbimento di questo ione e la sua deposizione nella matrice minerale dell'osso.
Torna a: didattica; pagina iniziale.