PRIMA FACOLTA' DI MEDICINA E CHIRURGIA - CLUPS DIETISTA; INFERMIERE; TECNICO DI LABORATORIO
SAPIENZA UNIVERSITA' DI ROMA
A causa della sua limitata elettronegativita', il carbonio e' l'unico elemento della tavola periodica i cui atomi possono legarsi tra loro senza limitaizoni di numero, generando cosi' molecole molto grandi e complesse. L'oggetto di studio della chimica organica sono queste molecole, i cui componenti principali, oltre al carbonio, sono H, N, O e talvolta anche S, P ed altri elementi. Molte molecole organiche sono di origine biologica ma ve ne sono altre che sono invece prodotte esclusivamente nei laboratori o dall'industria chimica.
Gli idrocarburi sono i composti binari di carbonio e idrogeno. Sono composti di remota origine biologica e vengono estratti da giacimenti sotterranei sotto forma di miscele di idrocarburi diversi (petrolio). Non sono presenti come tali nel nostro organismo (anzi sono spesso tossici), ma sono importanti perche' ogni composto organico e' descritto con riferimento all'idrocarburo piu' simile. La loro formula generale e' CnHm.
Gli idrocarburi possono essere classificati come segue:
IDROCARBURI ALIFATICI:
a catena aperta: alcani, alcheni, alchini e polieni;
a catena chiusa: cicloalcani e cicloalcheni; polieni ciclici.
IDROCARBURI AROMATICI (sempre a catena chiusa)
IDROCARBURI ALIFATICI: GLI ALCANI.
Gli alcani presentano la formula generale CnH2n+2 con n variabile tra 1 e 70. Tutti gli atomi di carbonio hanno ibridazione sp3 e geometria tetraedrica, e le molecole si presentano come lunghe catene di atomi di carbonio, lineari o ramificate:
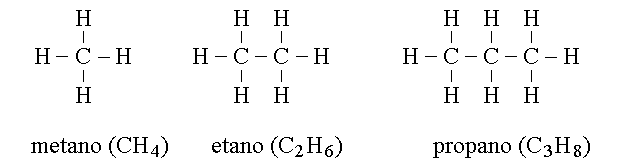
FORMULE RAZIONALI (o INTELLIGENTI). Nella chimica orgganica si fa spesso ricorso ad una notazione chiamata FORMULA RAZIONALE, diversa dalla formula bruta (l'elenco degli atomi presenti nel composto) e dalla formula di struttura (la rappresentazione dettagliata di tutti gli atomi etutti i legami). La formula razionale utilizza una rappresentazione analoga alla formula bruta per quei gruppi di atomi sulla cui disposizione non vi possono essere dubbi, e la notazione strutturale laddove questa sia essenziale e insostituibile. Ad esempio:
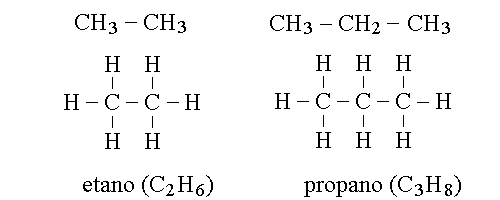
ISOMERIA NEGLI ALCANI. Fino al propano non abbiamo dubbi su come possano esere disposti gli atomi nella molecoladell'alcano; ma dell'idrocarburo successivo, il butano (C4H10), esistono due forme distinte e di quello ancora successivo, il pentano (C5H12), tre. Due o piu' molecole diverse che condividono la stessa formula bruta si definiscono ISOMERI. Ad esempio i due isomeri del butano hanno le formule:
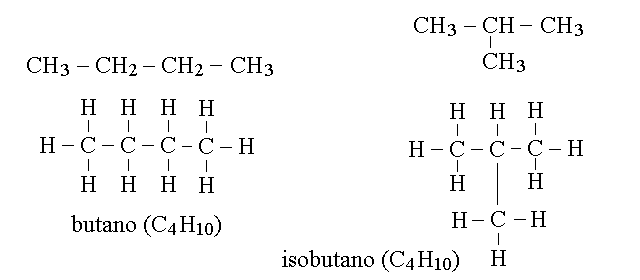
NUMERAZIONE DEGLI ATOMI DI CARBONIO. Gli atomi di carbonio delle molecole organiche sono numerati in modo tale da identificarli, secondo le regole seguenti:
1) si individua la catena lineare ininterrotta piu' lunga possibile, indipendentemente da come la molecola e' disegnata;
2) si prova a numerare gli atomi di carbonio da ciascuna estremita' e si scegli ecome inizio quella estremita' che assegna ai sostituenti (atomi o gruppi diversi da H) il numero piu' basso;
3) si assegna alla molecola il nome dell'idrocarburo lineare con il numero di atomi dicarbonio della catena trovata al precedente punto (1) e si nominano i sostituenti di conseguenza.
Ad esempio:
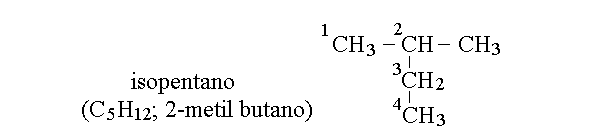
ALCHENI E ALCHINI. Gli alcheni presentano catene carboniose simili a quelle degli alcani, ma contenenti un doppio legame tra due atomi di carbonio con ibridazione sp2; gli alchini presentano un triplo legame tra due atomi di carbonio con ibridazione sp. La formula generale degli alcheni e' CnH2n; quella degli alchini CnH2n-2.
Esempi di alcheni. Etene: CH2=CH2; propene: CH2=CH-CH3; butene: CH2=CH-CH2-CH3.
Esempi di alchini. Etino: CH ≡ CH; propino: CH ≡ C-CH3; butino: CH ≡ C-CH2-CH3.
POLIENI. I polieni sono idrocarburi alifatici lineari che presentano due o piu' doppi legami. Ad esempio:
Butadiene: CH2=CH-CH=CH2.
1,4 Pentadiene: CH2=CH-CH=CH-CH3.
1,5 Pentadiene: CH2=CH-CH2-CH=CH2.
IDROCARBURI ALIFATICI CICLICI. La catena carboniosa degli alcani e degli alcheni puo' chiudersi su se stessa a formare un anello; si hanno allora i cicloalcani (formula generale CnH2n, come quella degli alcheni) e i cicloalcheni (formula generale CnH2n-2 come quella degli alchini). L'ibridazione sp3 caratteristica dei cicloalcani e di alcuni carboni degli alcheni non e' compatibile con una geometria planare; pertanto i cicloalcani e i cicloalcheni con piu' di tre atomi di carboniohanno frome caratteristiche; ad esempio il cicloesano puo' assumere due configurazioni spaziali distinte dette "a sedia" e "a barca".
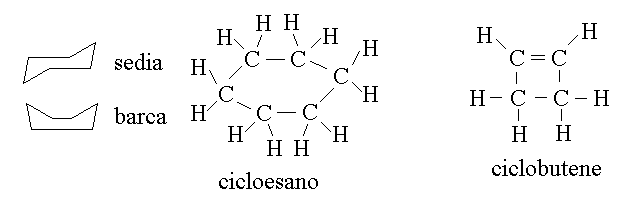
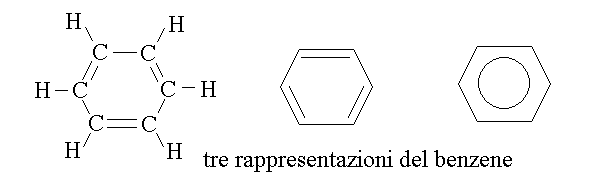
IDROCARBURI AROMATICI. Gli idrocarburi aromatici assomigliano a polieni ciclici a SEI atomi di carbonio; eccezionalmente ne ne sono a cinque o a sette. Tuttil gli atomi di carbonio presentano l'ibridazione sp2 e la geometria trigonale planare, con angoli di legame di 120o, perfettamente compatibile con la forma geometrica dell'esagono regolare. La forma di esqgono regolare consente la DELOCALIZZAZIONE degli orbitali di legame π, e questo, a sua volta, conferisce grande stabilita' alla molecola. Il piu' semplice degli idrocarburi aromatici e' il BENZENE:
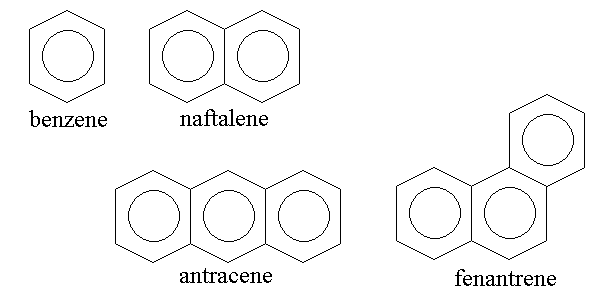
Gli idrocarburi aromatici non possono aumentare di dimensioni un carbonio alla volta , come gli alifatici; aumentano di dimensioni mediante la condensazione di piu' anelli a sei atomi di carbonio; i primi quattro della serie sono benzene (C6H6), naftalene (C10H8 e i due isomeri antracene e fenantrene (C14H10):
Gli idrocarburi aromatici possono presentare brevi catene alifatiche ai vertici dell'anello aromatico; ad esempio:
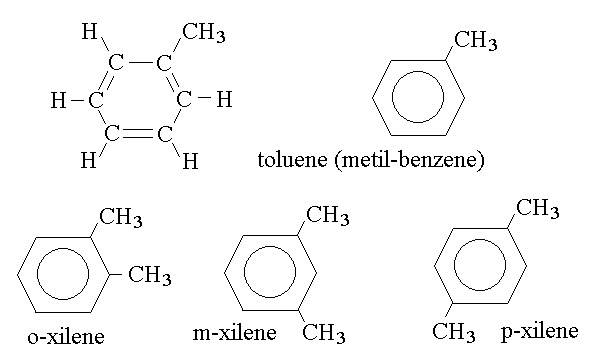
Si noti la nomenclatura delle posizioni sull'anello aromatico: la posizione "orto" dell'o-xilene (1,2 dimetil benzene); "meta" del m-xilene (1,3 dimetil benzene); "para" del p-xilene (1,4 dimetil benzene).
RESIDUI. Si definisce residuo (indicato in genere con R-) un composto immaginario, corrispondente ad un idrocarburo al quale sia stato sottratto un atomo di idrogeno (cioe' uno ione idrogeno con il suo elettrone). Il residuo presenta quindi un elettrone spaiato ed e' un radicale. Il residuo non esiste in natura da solo: come tutti i radicali e' instabile ed esiste soltanto in forma combinata con altri atomi o gruppi di atomi. Il residuo e' una astrazione utile per descrivere i composti piu' complessi come formati da vari residui o gruppi legati tra loro mediante orbitali di legame formati con gli elettroni spaiati di ciascun residuo o gruppo. Sono esempi di residui il metile, l'etile e il benzile:
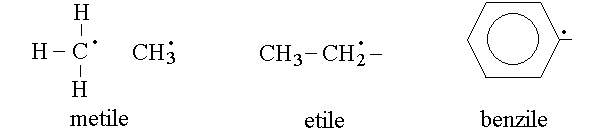
REAZIONI CARATTERISTICHE DEGLI IDROCARBURI.
La reazione caratteristica degli alcani e' la sostituzione:
CH3-CH3 + Cl2 --> CH3-CH2Cl + HCl
La reazione caratteristica degli alcheni e degli alchini (che per questo sono chiamati idrocarburi insaturi e' l'addizione:
CH2=CH2 + HCl --> CH3-CH2Cl
CH3-CH3 + H2O --> CH3-CH2OH
Gli aromatici, che sono formalmente insaturi per via della presenza dei doppi legami, danno pero' piu' facilmente la sostituzione che l'addizione (perche' quest'ultima, eliminando uno dei doppi legami, renderebbe impossibile la delocalizzazione dell'orbitale π che e' invece energeticamente favorita per ragioni entropiche).
CONSIDERAZIONE CONCLUSIVA SUI COMPOSTI DEL CARBONIO
Data la configurazione elettronica esterna del carbonio (4 elettroni nel 2 livello energetico) e le possibili ibridazioni dei suoi orbitali (sp, sp2, sp3), questo atomo puo' trovarsi nei composti soltanto in alcune configurazioni caratteristiche di legami chimici:
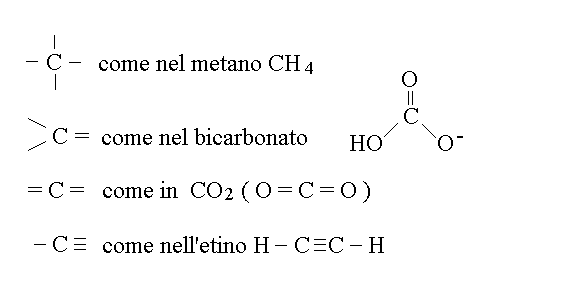
I composti del carbonio piu' complessi degli idrocarburi (cioe' i composti ternari o di ordine superiore) vengono descritti come se fossero formati da un residuo e da un gruppo di atomi comprendente O, N, S o P (gruppo funzionale) Sia il residuo che il gruppo funzionale sono radicali, cioe' hanno elettroni spaiati, e si combinano formando un legame chimico (in genere un legame semplice - orbitale σ).
Si descrivono:
1) i gruppi funzionali contenenti ossigeno
2) i gruppi funzionali contenenti azoto o azoto e ossigeno
3) i gruppi funzionali contenenti zolfo
4) i gruppi funzionali risultanti dalla combinazione dei precedenti tra loro o con acido fosforico (unico modo in cui il fosforo partecipa alla costituzione delle molecole biologiche).
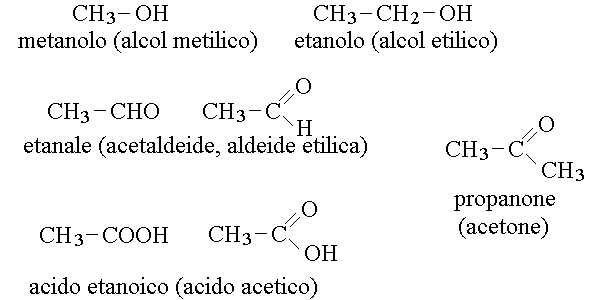
GRUPPI FUNZIONALI DELL'OSSIGENO. I principali gruppi funzionali dell'ossigeno sono tre: l'ossidrile (degli alcoli, -OH), il carbonile (delle aldeidi e dei chetoni, R-CHO e R-CO-R) ed il carbossile (degli acidi organici, R-COOH):
GRUPPI FUNZIONALI DELL'AZOTO. I gruppi funzionali dell'azoto sono due: l'ammina (o amina; R-NH2) e l'ammide (R-CONH2).
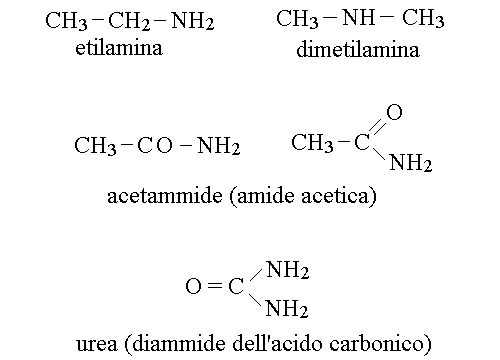
GRUPPI FUNZIONALI DELLO ZOLFO. In pratica l'unico gruppo funzionale importante dello zolfo e' il tiolo (-SH, analogo all'ossidrile dell'alcol); ad es. nell'etantiolo: CH3-CH2-SH.
GRUPPI FUNZIONALI DERIVANTI DALLA REAZIONE DEI PRECEDENTI TRA LORO O CON L'ACIDO FOSFORICO.
Due alcoli possono combinarsi tra loro per formare un ETERE (R-O-R), con eliminazione di una molecola d'acqua. Ad esempio:
2 CH3-OH <==> CH3-O-CH3 (etere dimetilico) + H2O
Un alcol puo' combinarsi con un ossiacido (organico o inorganico) per formare un ESTERE e una molecola d'acqua; ad esempio:
CH3-COOH + CH3-OH <==> CH3-CO-O-CH3 (acetato di metile) + H2O
CH3-OH + H3PO4 <==> CH3-O-PO3H2 (fosfato di metile) + H2O
ACETALI E CHETALI. Una aldeide puo' combinarsi con un alcol per formare un semiacetale; e un semiacetale puo' combinarsi con un'altra molecola di alcol per formare un acetale. Un chetone puo' andare incontro alla stessa serie di reazioni, ma i prodotti si chiamano semichetali e chetali. Ad esempio:
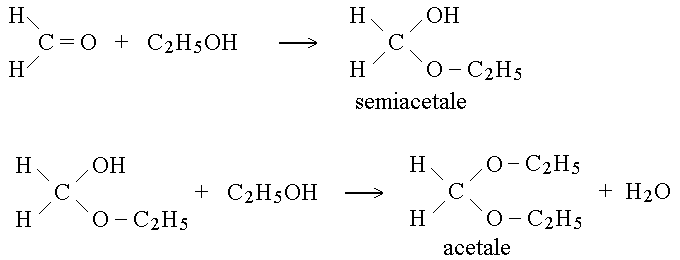
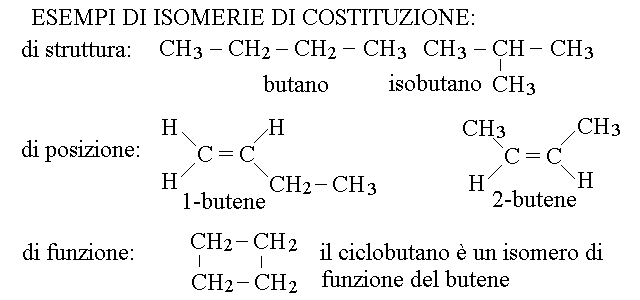
L'isomeria, gia' incontrata negli idrocarburi e' il fenomeno per cui molecole diverse condividono la stessa formula bruta mentre differiscono per la formula di struttura. Esistono 6 tipi di isomeria raccolti in due classi: di costituzione (i. di struttura, di posizione e di funzione) e steriche (i. conformazionale, i. geometrica, i. ottica).
I seguenti sono esempi delle tre classi di isomerie di costituzione:
Mentre quelli riportati sotto sono esempi delle tre classi di isomerie steriche
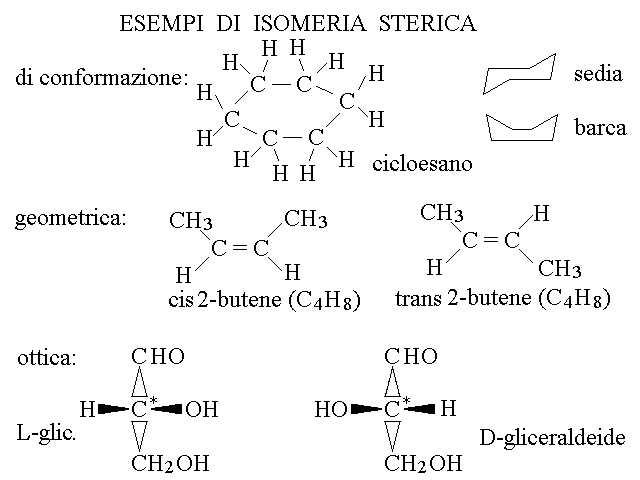
Torna a: didattica; pagina iniziale.