PRIMA FACOLTA' DI MEDICINA E CHIRURGIA - CLUPS DIETISTA; INFERMIERE; TECNICO DI LABORATORIO
SAPIENZA UNIVERSITA' DI ROMA
Lo ione idrogeno, H+, ha una struttura unica: infatti quando l'atomo di idrogeno perde il suo unico elettrone non ne rimane che il nucleo nudo, costituito da un protone. Lo studente puo' facilmente verificare sulla tavola periodica che la prima ionizzazione dell'elio, l'elemento successivo all'idrogeno, produce uno ione che possiede un elettrone nell'orbitale 1s, e quella del litio uno ione che ha due elettroni nell'orbitale 1s. Il nucleo dell'idrogeno ha un diametro molto piccolo, circa uncentomillesimo dell'orbitale 1s, e quindi lo ione idrogeno ha una densita' di carica molto grande, a causa della quale non rimane libero in soluzione ma tende a combinarsi reversibilmente con ioni o molecole che possiedono doppietti elettronici spaiati, accettando un legame dativo.
L'acqua, come pure altri solventi di minore interesse per la medicina, va incontro ad una reazione di dissociazione spontanea nella quale si libera uno ione idrogeno, subito catturato da un'altra molecola d'acqua e idratato (trasformato) a ione idronio:
2 H2O <==> H3O+ + OH-
Questa reazione, definita AUTOPROTOLISI, e' reversibile e raggiunge molto rapidamente uno stato di equilibrio, secondo la legge di azione delle masse:
K = [H3O+][OH-] / [H2O]2
L'autoprotolisi dell'acqua e' una reazione improbabile e a 25oC la concentrazione dei prodotti e' soltanto di 10-7 M (1 decimo di milionesimo di mole per litro). Poiche' la concentrazione dell'acqua e' molto grande rispetto a quella dei prodotti di reazione (cioe' la quantita' di acqua consumata nella reazione e' piccolissima rispetto al totale), la si puo' assumere costante e raccoglierla nella costante di equilibrio. Si ottiene cosi' una seconda costante chiamata PRODOTTO IONICO DELL'ACQUA (KW):
KW = K [H2O]2 = [H3O+][OH-]
Poiche' le concentrazioni dello ione idronio (H3O+) e dello ione ossidrile o idrossido (OH-) in acqua sono in genere molto piccole, risulta conveniente esprimerle in forma logaritmica. Si definisce con "p" il logaritmo in base 10 e cambiato di segno di un numero; cosi' pH e' il logaritmo decimale cambiato di segno della concentrazione molare dello ione idronio:
pH = -log10 [H3O+]
Allo stesso modo si indica con pOH il logaritmo decimale cambiato di segno della concentrazione molare dello ione ossidrile, con pKW quello del prodotto ionico dell'acqua e con pK quello di una qualunque costante di equilibrio:
pOH = -log10 [OH-]
pKW = -log10 KW = 14 = pH + pOH
Ci sono varie definizioni di acido e base; quella piu' adatta agli scopi delle applicazioni biomediche della chimica e' quella di Bronsted e Lowry che definisce ACIDO una sostanza capace di cedere uno ione H+ e BASE una sostanza che puo' combinarsi con uno ione H+. Le reazioni acido-base secondo questa teoria sono quindi scambi di ioni H+ tra un donatore (l'acido) e un accettore (la base). Ad esempio l'acido cloridrico puo' scambiare uno ione idrogeno con l'acqua (base) nella reazione:
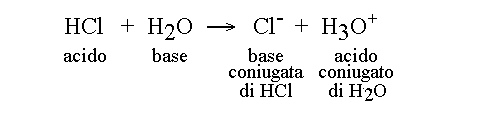
Il prodotto della reazione di dissociazione di un acido, cioe' l'acido privato dello ione idrogeno, prende il nome di BASE CONIUGATA di quell'acido perche' potrebbe, nella reazione inversa combinarsi con uno ione idrogeno e riformare l'acido di partenza (cioe' Cl- e' la base coniugata di HCl perche' potrebbe ricombinarsi con uno ione idrogeno e riformare HCl).
Quando il solvente (come l'acqua) e' capace di autoprotolisi, lo ione idrogeno, che non puo' trovarsi isolato in soluzione per la sua reattivita', puo' combinarsi con le molecole del solvente (nel caso dell'acqua formando lo ione idronio). Lo scambio di ione idrogeno avviene quindi in questo caso tra l'acido e il solvente.
Nel caso delle basi in soluzione acquosa valgono le stesse considerazioni fatte per gli acidi ma i ruoli del soluto e del solvente si invertono. Ad esempio nella dissociazione dell'ammoniaca in acqua si ha:
NH3 + H2O <==> NH4+ + OH-
In questa reazione l'ammoniaca e' la base e accetta uno ione idrogeno donato dall'acqua (che si comporta quindi come acido). Il prodotto della combinazione dello ione idrogeno con la base costituisce l'ACIDO CONIUGATO di quella base perche' nella reaizone inversa potrebbe dissociare lo ione idrogeno e riformare la base di partenza (cioe' NH4+ e' l'acido coniugato di NH3 perche' cedendo uno ione idrogeno potrebbe riformare NH3).
ACIDI FORTI E ACIDI DEBOLI; BASI FORTI E BASI DEBOLI. Si chiama acido forte un acido che dissocia irreversibilmente in acqua, acido debole uno che dissocia reversibilmente. Ad esempio:
ACIDO FORTE: HCl + H2O --> H3O+ + Cl-
ACIDO DEBOLE: HNO2 + H2O <==> H3O+ + NO2-
Si chiama base forte una base che si converte integralmente e irreversibilmente nel suo acido coniugato e nella base coniugata del solvente, base debole una che lo fa solo parzialmente, in una reazione reversibile. Ad esempio:
BASE FORTE: NaOH --> Na+ + OH-
BASE DEBOLE: NH3 + H2O <==> NH4+ + OH-
CALCOLO DEL pH DEGLI ACIDI E DELLE BASI. L'acido forte dissocia completamente; pertanto se noi indichiamo con Ca la sua concentrazione analitica (cioe' il numero di moli per litro, a prescindere dallo stato dissociato o indissociato), si ha:
[H3O+] = Ca
L'acido debole stabilisce una condizione di equilibrio governata dalla legge di azione delle masse. Indicando con HA un generico acido debole e con A- lo ione che risulta dalla sua dissociazione, e includendo la concentrazione dell'acqua nella costante di equilibrio, si puo' scrivere:
Ka = [H3O+][A-] / [HA]
Facendo le due approssimazioni [H3O+]=[A-] e [HA] = Ca si puo' ottenere:
[H3O+] = √ (Ka Ca)
Cobn ragionamento analogo a quello condotto per gli acidi e le basi si ricava:
per le BASI FORTI: [OH-] = Cb
per le BASI DEBOLI: [OH-] = √ (Kb Cb)
Se si vuole calcolare la concentrazione dello ione idronio nel caso delle basi deboli, si deve ricordare la relazione KW = [H3O+][OH-], dalla quale si ricava: [H3O+] = KW / [OH-]
DEFINIZIONI DI NEUTRALITA', ACIDITA', BASICITA'.
La concentrazione dello ione idronio nell'acqua pura, alla quale non sono stati aggiunti acidi o basi e' uguale a quella dello ione ossidrile. Poiche' KW = 10-14 M2, si puo' facilmente calcolare che nell'acqua pura:
[H3O+] = [OH-] = √ KW = 10-7 M
pH = -log10 [H3O+] = 7
pOH = -log10 [OH-] = 7
Una soluzione nella quale pH = pOH = 7 e' definita NEUTRA.
Se una soluzione contiene un acido o una base, la relazione pH = pOH che era valida per l'acqua pura non vale piu' e si ha invece:
nel caso degli ACIDI: [H3O+] > [OH-]
[H3O+] > 10-7 M
pH < 7 (con pOH > 7 e pKW sempre uguale a 14)
nel caso delle BASI: [OH-] > [H3O+]
[OH-] > 10-7 M
pOH < 7 (con pH > 7 e pKW sempre uguale a 14)
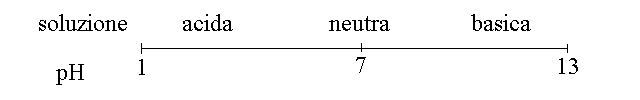
In conclusione la soluzione e':
ACIDA se ha pH < 7
NEUTRA se ha pH = 7
BASICA se ha pH > 7
In forma grafica:
I sali sono composti nei quali uno ione positivo e' legato ad uno ione negativo mediante un legame ionico. Se vengono disciolti in acqua il legame ionico si spezza e i due ioni si separano. Ad esempio:
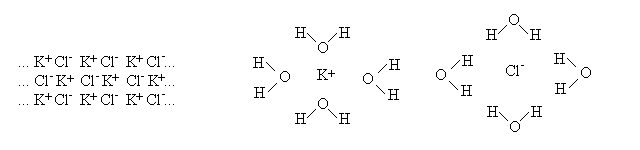
Uno dei due ioni derivanti dalla dissociazione del sale potrebbe essere la base coniugata di un acido debole o l'acido coniugato di una base debole; se questo avviene si ha la reazione dell'IDROLISI SALINA, che rende acido o basico il pH della soluzione.
IDROLISI BASICA. Un esempio di idrolisi basica interessante per la medicina e' dato dal bicarbonato di sodio:
NaHCO3 --> Na+ + HCO3-
HCO3- + H2O <==> H2CO3 + OH-
L'acido carbonico formato in questa reazione puo' andare incontro ad una ulteriore reazione (che non e' un'idrolisi):
H2CO3 <==> CO2 + H2O
E' importante sottolineare che tutte queste reazioni avvengono anche all'interno del nostro organismo. Per le formule di struttura di questi composti si veda la lezione 1 (atomi e molecole).
IDROLISI ACIDA. Un sale importante per la medicina che da questo tipo di idrolisi e' il cloruro di ammonio, le cui reazioni sono:
NH4Cl --> NH4+ + Cl-
NH4+ + H2O <==> NH3 + H3O+
La soluzione di un acido debole ed un suo sale (o di una base debole ed un suo sale) e' chiamata SOLUZIONE TAMPONE. Una proprieta' essenziale delle soluzioni tampone e' la capacita' di mantenere approssimativamente costante il pH anche a fronte di aggiunte di acidi o basi. Per capire il meccanismo di funzionamento dei tamponi occorre chiedersi in primo luogo quali equilibri si instaurino in soluzione, ed in secondo luogo come questi equilibri rispondano all'aggiunta di acidi o di basi.
Le soluzioni tampone sono molto importanti in medicina; ad esempio il sangue contiene vari sistemi tampone che ne mantengono il pH al valore costante di 7,4, con oscillazioni in piu' o in meno di sole 0,04 unita' di pH.
Un esempio di tampone e' quello costituito dall'acido formico e dal suo sale formiato di sodio, che in acqua vanno incontro alle seguenti dissociazioni:
Formiato di sodio: HCOONa --> HCOO-+ Na+
Acido formico: HCOOH + H2O <==> HCOO- + H3O+
La costante di equilibrio della dissociazione reversibile dell'acido formico e':
Ka = [HCOO-][H3O+] / [HCOOH]
Poiche' il sale e' completamente dissociato negli ioni costituenti, mentre l'acido lo e' solo in piccola parte, si possono scrivere le seguenti approssimazioni (indicando con Cs la concentrazione del sale e con Ca quella dell'acido):
Cs = [HCOO-]
Ca = [HCOOH]
Possiamo quindi riscrivere la Ka in questo modo:
Ka = Cs [H3O+] / Ca
Da quest'ultima formula si ricava:
[H3O+] = Ka Ca / Cs
che, trasposta in forma logaritmica, ci da l'equazione di Henderson e Hasselbalch:
pH = pKa + log (Cs / Ca)
dove pKa = -log Ka
Come si vede, il pH del tampone e' collegato al rapporto tra le concentrazioni del sale e dell'acido, che possono essere anche molto grandi; questo inibisce le variazioni del pH.
Cosa accade se si aggiunge un acido o una base ad una soluzione tampone?
L'aggiunta di un acido estraneo al tampone (ad es. HCl) trasforma una piccola quantita' di sale in acido, secondo la reazione irreversibile:
HCOONa + HCl --> HCOOH + NaCl
L'aggiunta di una base estranea al tampone (ad es. NaOH) trasforma una piccola quantita' di acido in sale, secondo la reazione irreversibile:
HCOOH + NaOH --> HCOONa + H2O
In entrambi i casi si ha una piccola variazione del pH, molto inferiore a quella che si verificherebbe se l'acido o la base fossero aggiunti all'acqua o a una soluzione non tamponata.
(Testo riveduto a marzo 2013)
Torna a: didattica; pagina iniziale.