PRIMA FACOLTA' DI MEDICINA E CHIRURGIA - CLUPS DIETISTA; INFERMIERE; TECNICO DI LABORATORIO
SAPIENZA UNIVERSITA' DI ROMA
Le REAZIONI CHIMICHE sono processi nei quali alcune molecole (dette reagenti) si scambiano atomi tra loro per convertirsi in nuove molecole (dette prodotti). Ad esempio:
CaO + H2O --> Ca(OH)2
In questa reazione CaO e H2O sono i reagenti; Ca(OH)2 e' il prodotto. La freccia indica la direzione in cui la reazione procede e poiche' e' singola indica anche che la reazione e' praticamente irreversibile (cioe' il prodotto ha scarsa tendenza a ritrasformarsi nei reagenti).
2 SO2 + O2 <==> 2 SO3
In questa reazione l'anidride solforosa e l'ossigeno sono i reagenti, l'anidride solforica e' il prodotto. La doppia freccia indica che la reazione e' reversibile (cioe' intanto che i reagenti si convertono in prodotto una parte del prodotto si riconverte nei reagenti). I numeri che precedono le formule si chiamano COEFFICIENTI STECHIOMETRICI e consentono alla formula scritta di conservare costante il numero degli atomi coinvolti nella reazione (infatti nelle reazioni chimiche gli atomi non si creano e non si consumano, cambiano soltanto i legami che essi formano).
Che cosa accade durante la reazione chimica? Alcune molecole (i reagenti) si convertono in altre molecole (i prodotti). Questo passa attraverso la rottura di legami chimici e la formazione di nuovi legami chimici. Ad esempio:
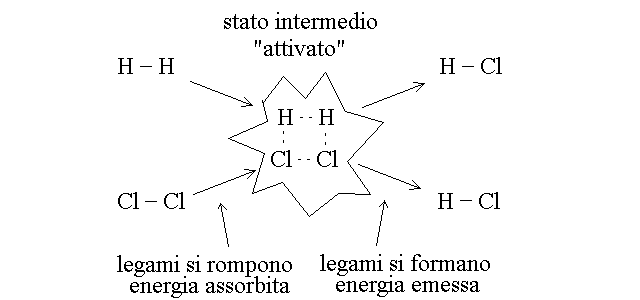
LEGGI DI CONSERVAZIONE. Nel corso di una reazione chimica la massa, la carica netta e gli atomi (o i grammoatomi) dei reagenti consumati sono uguali a quelli dei prodotti formati: si dice che questi parametri si conservano. Per illustrare questo concetto e' importante premettere che la formulazione delle reazioni chimiche puo' essere riferita indifferentemente alle molecole o alle moli dei reagenti e dei prodotti. Ad esempio l'espressione:
CaO + H2O --> Ca(OH)2
puo' essere letta in due modi legittimi: una molecola di ossido di calcio reagisce con una molecola d'acqua per formare una molecola di idrossido di calcio; oppure, una mole di ossido di calcio reagisce con una mole d'acqua per formare una mole di idrossido di calcio.
1) Le molecole dei reagenti contengono gli elementi Ca, O ed H; in particolare una molecola di ossido di calcio contiene 1 atomo di Ca ed 1 atomo di O, mentre una molecola di acqua contiene 2 atomi di H ed 1 atomo di O. Pertanto i reagenti contengono globalmente 1 Ca, 2 O e 2 H. La molecola del prodotto contiene 1 atomo di Ca, 2 atomi di O e 2 atomi di H. La reazione quindi non ha ne' prodotto ne' consumato ne' cambiato gli atomi.
2) Le molecole dei reagenti hanno carica elettrica netta totale uguale a zero; il prodotto ha carica netta uguale a zero. La reazione quindi non ha ne' prodotto ne' consumato cariche elettriche.
3) Leggendo lo schema di reazione in relazione alle moli dei reagenti e dei prodotti, anziche' delle molecole osserviamo che 1 mole di ossido di calcio, che ha massa pari a 56 g reagisce con una mole di acqua, che pesa 18 g per formare una mole di idrossido di calcio che pesa 74 g. Pertanto 56 + 18 = 74 g complessivi di reagenti si sono convertiti in 74 g di prodotto e la reazione non ha ne' consumato ne' prodotto materia (questa e' una ovvia conseguenza del punto 1, gia' considerato).
CONSERVAZIONE DELL'ENERGIA. Nel corso di una reazione chimica si conserva anche l'energia; poiche' l'energia chimica puo' essere conservata nei legami chimici o liberata all'esterno (in genere sotto forma di calore), bilanciare una reazione chimica rispetto all'energia comporta scrivere un termine che tenga conto dell'energia liberata o assorbita; ad esempio:
CaO + H2O --> Ca(OH)2 + Q
In questa equazione chimica il termine Q indica il calore emesso dalla reazione.
Se il calore compare tra i prodotti di reazione (cioe' se la reazione quando avviene produce calore) si dice che la reazione e' esotermica o esoergonica; se invece il calore compare tra i reagenti (cioe' se la reazione quando avviene assorbe calore) si dice che la reazione e' endotermica o endoergonica.
Le reazioni di ossido-riduzione comportano trasferimento parziale o completo di elettroni da un atomo ad un altro. Nelle molecole dei reagenti gli elettroni che saranno trasferiti risultano legati ad atomi poco elettronegativi, nelle molecole dei prodotti gli elettroni sono legati ad atomi piu' elettronegativi. Ad esempio la reazione di formazione dell'acqua:
2 H2 + O2 <==> 2 H2O
e' una reazione di ossido-riduzione perche' gli elettroni nella molecola di idrogeno, dove occupano un legame covalente omopolare, vengono trasferiti nel legame eteropolare tra O ed H, cosa che comporta il loro effettivo, anche se parziale trasferimento da H (elettronegativita' = 2,1) ad O (elettronegativita' = 3,5).
NUMERO DI OSSIDAZIONE. Per identificare correttamente una reazione di ossido-riduzione si assegna una carica formale (fittizia) ad ogni atomo in ogni molecola di reagente o prodotto, fingendo che tutti i legami covalenti polari siano ionici (cioe' trasformando i trasferimenti di elettroni interni alla molecola da parziali in completi). Questa carica formale costituisce il NUMERO DI OSSIDAZIONE (n.o.) di ogni atomo in un composto. In pratica, per assegnare ad ogni atomo il suo numero di ossidazione bisogna controllare sulla tavola periodica l'elettronegativita' di ogni atomo ed assegnare entrambi gli elettroni di ogni legame all'atomo piu' elettronegativo. Nel caso dei legami covalenti omopolari non si assume nessun trasferimento di carica e quindi si assegna n.o.=0. Ad esempio:
2 H20 + O20 <==> 2 H2+1O-2
In questa reazione (formazione dell'acqua) i reagenti sono le due molecole di idrogeno e ossigeno che hanno entrambe soltanto legami covalenti omopolari; quindi il n.o. degli atomi dei reagenti (H in H2 e O in O2) e' pari a zero. Il prodotto, la molecola di acqua, contiene legami covalenti polari (l'elettronegativita' di H e' 2,1, quella di O e' 3,5) e quindi gli elettroni di legame vengono tolti all'atomo meno elettronegativo (H) ed assegnati al piu' elettronegativo (O). I numeri di ossidazione risultano +1 per H in H2O e -2 per O in H2O.
Se la reazione considerata e' una ossido-riduzione si osserva che almeno due atomi cambiano il loro n.o. nel passare dai reagenti ai prodotti (questo e' il caso dell'esempio visto sopra).
STATO DI OSSIDAZIONE. Si chiama STATO OSSIDATO di un atomo quello che ha il numero di ossidazione piu' alto (piu' positivo o meno negativo) e STATO RIDOTTO quello che ha il numero di ossidazione piu' basso (piu' negativo o meno positivo. Ad esempio nella reazione di formazione dell'acqua vista sopra gli stati di ossidazione dell'idrogeno sono i seguenti: H+ (in H2O) e' lo stato ossidato, mentre H0 (in H2) e' lo stato ridotto. Gli stati di ossidazione dell'ossigeno sono invece: O-2 (in H2O) e' lo stato ridotto, mentre O0 (in O2) e' lo stato ossidato.
L'atomo il cui numero di ossidazione aumenta nella reazione si ossida (H nell'esempio di cui sopra, perche' il suo n.o. passa da 0 nei reagenti a +1 nel prodotto); quello il cui numero di ossidazione diminuisce si riduce (O nell'esempio di cui sopra, perche' il suo n.o. passa da 0 nei reagenti a -2 nel prodotto). Poiche' l'elemento che si ossida riduce il suo partner di reazione esso e' anche chiamato RIDUCENTE, mentre quello che si riduce ossida il suo partner ed e' chiamato OSSIDANTE.
Tutte le reaioni chimiche sono reversibili almeno in linea di principio, ma solo alcune lo sono in quantita' misurabile. Quando una reazione e' reversibile essa non progredisce fino al completo consumo dei reagenti, ma sembra arrestarsi in una condizione in cui sono presenti insieme sia i reagenti che i prodotti, chiamata CONDIZIONE DI EQUILIBRIO. Questo avviene perche' mentre i reagenti si convertono in prodotti, i prodotti seguendo la reazione inversa si convertono in reagenti e nella condizione di equilibrio la velocita' con cui i reagenti si consumano (formando i prodotti) eguaglia quella con cui si formano (a partire dai prodotti).
LEGGE DI AZIONE DELLE MASSE. Quando una reazione chimica ha raggiunto la condizione di equilibrio, vale la legge di azione delle masse che stabilisce che E' COSTANTE IL RAPPORTO TRA IL PRODOTTO DELLE CONCENTRAZIONI DEI PRODOTTI ED IL PRODOTTO DELLE CONCENTRAZIONI DEI REAGENTI, CIASCUNA ELEVATA AL PROPRIO COEFFICIENTE STECHIOMETRICO.
Ad esempio si consideri la seguente reazione reversibile:
N2 + 3 H2 <==> 2 NH3
La legge delle masse (applicata dopo il raggiungimento della condizione di equilibrio) stabilisce che:
K = [NH3]2 / [N2][H2]3
In questa formula le parentesi quadrate indino le concentrazioni molari e K indica la costante di equilibrio. La costante di equilibrio e' la stessa qualunque siano le concentrazioni iniziali dei reagenti e dei prodotti e varia soltanto con la temperatura.
La cinetica chimica studia la velocita' con cui avvengono le reazioni chimiche e, per la grande correlazione tra i due argomenti, anche il meccanismo attraverso il quale esse avvengono.
La velocita' di reazione e' definita come il rapporto tra la variazione di concentrazione del reagente (presa con segno negativo) e l'intervallo di tempo considerato: ad esempio per la reazione irreversibile A --> B, la velocita' di reazione e' definita come:
v = -d[A]/dt = d[B]/dt
Una reazione di questo tipo, nella quale interviene una sola molecola di reagente e' definita MONOMOLECOLARE. Se il meccanismo di reazione e' semplice (cioe' non richiede la formazione di intermedi di reazione semi-stabili) la velocita' e' proporzionale alla concentrazione del reagente e ad una costante (costante cinetica):
v = -d[A]/dt = k[A]
Una reazione del tipo A + B --> C nella quale sono richiesti due reagenti e' definita BIMOLECOLARE e la sua legge cinetica assume la forma:
v = -d[A]/dt = = -d[B]/dt = d[C]/dt = k[A][B]
Si definisce ORDINE di una reazione chimica il grado del monomio o del polinomio che ne esprime la legge cinetica. Ad esempio nella reazione monomolecolare vista sopra la legge cinetica v=k[A] risulta di primo grado e quindi l'ordine di reazione e' uguale ad uno; invece nella reazione bimolecolare dell'esempio sopra riportato la legge cinetica v=k[A][B] risulta di secondo grado e quindi l'ordine e' uguale a 2. E' importante sottolineare che l'ordine di reazione coincide con la molecolarita' soltanto nel caso di reazioni semplici, il cui meccanismo non passa attraverso intermedi di reazione semi-stabili. Di conseguenza l'ordine di reazione non puo' essere predetto dalla stechiometria dei reagenti e deve essere determinato sperimentalmente!
La costante cinetica di una reazione chimica dipende fondamentalmente dalla barriera energetica che i reagenti devono superare per potersi trasformare nei prodotti: infatti le reazioni chimiche devono sempre iniziare con la rottura o o almeno l'indebolimento di legami chimici (cioe' di orbitali di legame) e questo processo richiede energia (si veda la figura e la discussione riportate all'inizio di questo capitolo). L'energia necessaria affinche' si rompano i legami chimici presenti nelle molecole dei prodotti si chiama ENERGIA DI ATTIVAZIONE e lo stato dei reagenti nel quale i legami interessati sono rotti o indeboliti si chiama il suo STATO ATTIVATO. Quanto maggiore e' l'energia di attivazione di una reazione chimica tanto minore e' la sua costante cinetica. L'energia di attivazione puo' essere rappresentata su un grafico cartesiano come segue:
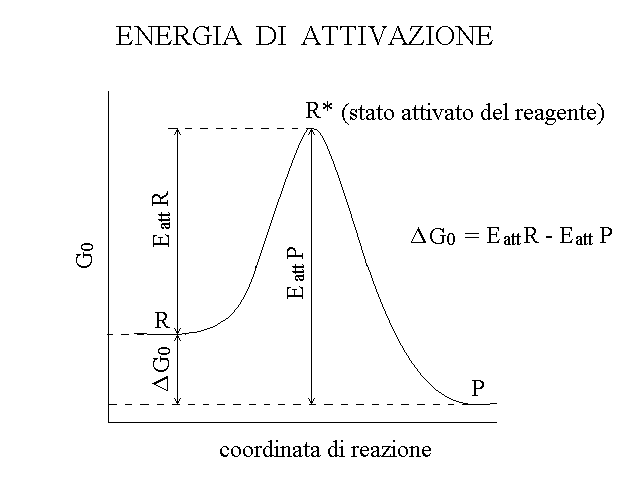
In questo grafico l'ascissa riporta la coordinata di reazione, un qualsiasi parametro in grado di distinguere i reagenti dai prodotti (ad es. una lunghezza di legame) e l'ordinata riporta un parametro energetico (in genere G, piu' raramente H o S).
Torna a: didattica; pagina iniziale.