PRIMA FACOLTA' DI MEDICINA E CHIRURGIA - CLUPS DIETISTA; INFERMIERE; TECNICO DI LABORATORIO
SAPIENZA UNIVERSITA' DI ROMA
I LEGAMI (INTERAZIONI) DEBOLI si instaurano in genere tra molecola, anziche' tra atomi come i legami forti) e non dipendono dalla formazione di orbitali di legame ma da attrazione elettrostatica. La piu' importante interazione debole e' il legame dipolo-dipolo che si instaura tra molecole dipolari, aventi una estremita' positiva e una estremita' negativa, quali ad esempio l'acido cloridrico:
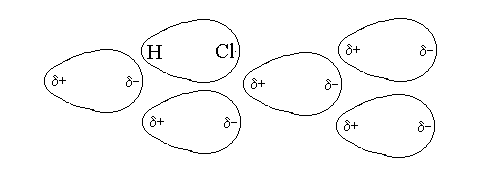
Nell'interazione dipolo-dipolo le molecole dipolari si dispongono in modo ordinato, tale per cui l'estremita' positiva di ciascuna si trova vicina all'estremita' negativa della molecola piu' prossima.
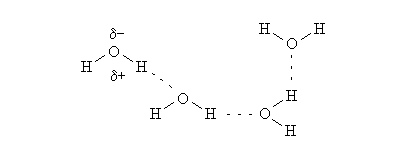
IL LEGAME IDROGENO. Il legame idrogeno e' un caso particolare di interazione dipolo-dipolo che si instaura quando il polo positivo del dipolo e' un atomo di idrogeno. Poiche' l'atomo di idrogeno possiede un solo elettrone, quando esso si impegna in un legame covalente polare, il suo nucleo viene praticamente denudato, e la densita' di carica positiva corrispondente e' molto alta. Pertanto il legame idrogeno ha una energia relativamente elevata (3-5 kcal/mole, circa un decimo dell'energia di un legame forte). Un esempio di legame idrogeno si osserva nell'acqua:
LE FORZE DI VAN DER WAALS. Anche molecole che non sono dipoli stabili presentano occasionali addensamenti e rarefazioni di carica nei loro orbitali, dovuti al movimento degli elettroni. Questo genera deboli campi elettromagnetici sulla superficie delle molecole, in conseguenza dei quali si stabiliscono interazioni attrattive o repulsive intermolecolari, con energie molto basse. Se le molecole interagenti hanno superfici di contatto ampie e complementari, queste interazioni possono risultare non trascurabili.
Quando le molecole che costituiscono una porzione di materia non interagiscono tra loro mediante interazioni deboli, o formano interazioni deboli di intensita' cosi' bassa da poter essere rotte dal movimento delle molecole stesse (cioe' quando l'energia dei legami deboli e' molto inferiore all'energia cinetica delle molecole) la sostanza assume lo stato del GAS PERFETTO, che obbedisce all'equazione di stato:
P V = n R T
Dove P e' la pressione, V il volume, n la quantita' di materia misurata in numero di moli, R una costante e T la temperatura misurata in Kelvin.
Quando le molecole interagiscono tra loro con legami deboli di energia bassa, ma non trascurabile rispetto alla loro energia cinetica si ha uno stato gassoso leggermente diverso dal precedente che si chiama del GAS REALE e che non obbedisce esattamente all'equazione di stato.
Se l'energia cinetica delle molecole e' dello stesso ordine di grandezza di quella delle interazioni deboli che le molecole possono stabilire tra loro, le interazioni si formano e si spezzano continuamente e le molecole, anziche' separarsi come avviene nei gas rotolano e si muovono rimanendo tra loro in contatto. Questo e' lo STATO LIQUIDO.
Quasi tutti i liquidi che incontriamo in natura sono costituiti da molecole ben definite che contraggono tra loro interazioni deboli. L'acqua liquida e' un buon esempio: le molecole sono tra loro aggregate in gruppi di poche decine da interazioni deboli che si rompono e si formano continuamente.
Se, infine, l'energia cinetica delle molecole e' di molto inferiore a quella dei legami deboli intermolecolari, le molecole non possono che vibrare intorno a posizioni fisse e si ha lo STATO SOLIDO.
I solidi tipici hanno struttura CRISTALLINA e si presentano come corpi con una propria forma, talvolat di mirabile regolarita' geometrica: si pensi ad esempio al diamante, ed in genere alle pietre preziose, o al cloruro di sodio (il comune sale da cucina). La forma del solido non e' casuale ma riflette la disposizione spaziale ordinata delle molecole o degli atomi che lo costituiscono (il cosiddetto RETICOLO cristallino): le particelle infatti sono orientate e fissate nello spazio dai legami che si stabiliscono tra loro.
Esistono in natura corpi all'apparenza solidi, cioe' dotati di forma propria, non comprimibili, etc. ma privi della struttura cristallina. Questi sono definiti SOLIDI AMORFI e da un punto di vista della struttura molecolare assomigliano a liquidi molto viscosi piuttosto che a cristalli. Ne sono esempi il vetro e la cera. Non hanno grande interesse per la medicina.
I CAMBIAMENTI DI STATO. L'energia dei legami che le molecole possono formare tra loro e' sostanzialmente indipendente dalla temperatura, per ogni tipo di molecola; ad esempio le molecole d'acqua formano tra loro legami idrogeno con energia di circa 5 kcal/mole a tutte le temperature. Per contro, l'energia cinetica delle molecole dipende dalla temperatura. Consegue che quando un corpo viene riscaldato, l'energia cinetica delle sue molecole viene aumentata e puo' superare quella dei legami deboli, fino al punto che un solido puo' convertirsi in un liquido e un liquido in un gas. Consegue ancora che a base temperature tutte le sostanze tendono allo stato solido e ad alta temperatura tutte tendono allo stato gassoso.
I cambiamenti di stato ai quali le sostanze vanno incontro in seguito ai cambiamenti di temperatura prendono i seguenti nomi:
| solido --> liquido | fusione | liquido --> solido | solidificazione | |
| liquido --> gas | evaporazione | gas --> liquido | liquefazione | |
| solido --> gas | sublimazione | gas --> solido | brinamento |
I CONCETTI DI STATO E DI FASE TERMODINAMICA. Lo stato di aggregazione (gassoso, liquido o solido) non deve essere confuso con la fase termodinamica, che indica un corpo o porzione di materia nel quale le molecole abbiano o possano avere intimo contatto reciproco). Una miscela di gas diversi costituisce sempre un'unica fase termodinamica; un sistema costituito da liquido in equilibrio con il suo vapore forma due fasi termodinamiche perche' il contatto intermolecolare tra le due fasi liquida e gassosa e' possibile soltanto all'interfaccia e non c'e' intimo mescolamento tra le molecole; una bottiglia di acqua chiusa nella quale siano presenti lo stato liquido in equilibrio con il suo vapore e due cubetti di ghiaccio contiene tre stati di aggregazione e quattro fasi termodinamiche perche' ogni cubetto del solida fa fase a se (non c'e' mescolamento o interazione possibile tra le molecole di due corpi solidi distinti).
Si definsce OMOGENEO un sistema termodinamico i cui componenti occupano tutti la medesima fase ed ETEROGENEO uno nel quale suono presenti due o piu' fasi termodinamiche.
La mole o grammomolecola e' una unita' di misura della quantita' di materia, applicabile alle sostanze pure, di composizione definita:
UNA MOLE E' QUELLA QUANTITA' DI SOSTANZA CHE CONTIENE UN NUMERO DI AVOGADRO DI MOLECOLE E PESA TANTI GRAMMI QUANTE SONO LE UNITA' DI MASSA ATOMICA DEL PESO MOLECOLARE.
Il numero di Avogadro e' pari a 6,02x1023 molecole/mole e di fatto parlare di una mole e' come parlare di una dozzina o di un migliaio. La particolarita' del numero di Avogadro sta nel fatto che esso corrisponde al rapporto tra il grammo e l'unita' di massa atomica:
num. Avogadro = massa di 1 g / massa di 1 U.M.A. espressa in g
Il PESO MOLECOLARE di una sostanza si calcola facilmente (se e' nota la formula) dalla somma dei pesi atomici; noto questo il calcolo del numero di moli e':
n = peso della sostanza (in grammi) / PM.
Si definisce SOLUZIONE una miscela di sostanze che condividono tutte la medesima fase; la soluzione e' quindi OMOGENEA dal punto di vista termodinamico (ma eterogenea dal punto di vista chimico perche' miscela di sostanze diverse e separabili). Le soluzioni possono trovarsi nello stato gassoso (e allora sono piu' spesso definite miscele gassose); per la medicina la piu' importante delle miscele gassose e' l'aria che respiriamo. Possono trovarsi nello stato liquido e questo e' il caso piu' rilevante per la medicina (il nostro corpo e' prevalentemente costituito da soluzioni acquose). Possono infine trovarsi nello stato solido, come avviene per le leghe metalliche, che hanno qualche interesse per le tecnologie mediche (protesi, otturazioni dentarie, etc.).
I COMPONENTI DELLE SOLUZIONI. Le soluzioni sono costituite da almeno due sostanze diverse, delle quali quella presente in maggiore quantita' prende il nome di SOLVENTE, l'altra (o le altre) quello di SOLUTO (o soluti). Il genere lo stato di aggregazione della soluzione e' quello che il solvente avrebbe se fosse da solo nelle condizioni di temperatura e pressione considerate, ma esistono piccole variazioni (ad es. la soluzione liquida ha punti di congelamento e di ebollizione diversi da quelli del solvente puro).
CONCENTRAZIONE DELLE SOLUZIONI. Si definisce concentrazione (del soluto o della soluzione) il rapporto tra la quantita' di soluto e la quantita' di solvente o di soluzione. La concentrazione puo' essere espressa in varie unita' di misura; hanno interesse per la medicina:
1) la percentuale peso/volume: grammi di soluto presenti in 100 ml di soluzione (solo per le soluzioni liquide);
2) la percentuale volume/volume: ml di soluto presenti in 100 ml di soluzione (solo nei casi in cui il soluto, nella sua forma pura, e' un liquido o un gas; ad es. il tasso di alcol nel vino);
3) la molarita' (M): numero di moli di soluto presenti in 1 litro di soluzione;
4) la normalita' (N o Eq/l): numero di equivalenti di soluto presenti in 1 litro di soluzione.
ALCUNI ESEMPI DI MISURE DI CONCENTRAZIONE:
1) la concentrazione del glucosio nel sangue (GLICEMIA) e' espressa come percentuale peso/volume; nell'uomo sano a digiuno risulta di circa 80 mg/100 ml (o 80 mg/dl);
2) la concentrazione del colesterolo nel sangue (COLESTEROLEMIA) si misura con le stesse unita' della glicemia ed in genere e' di circa 200 mg/100 ml.
3) La concentraizone del bicarbonato e dell'anidride carbonica nel sangue sono in genere espresse in molarita'; nell'uomo sano a riposo il valore medio di questi parametri e' di circa 28 mM per il bicarbonato e 1,3 mM per l'anidride carbonica.
4) La concentrazione degli ioni del sangue si esprime in genere in mEq/l; ad esempio la sodiemia e' para a circa 135 mEq/l.
SOLUBILITA' E SATURAZIONE. Per molte coppie soluto-solvente esiste una concentrazione massima, raggiunta la quale il soluto non e' piu' solubile e precipita, formando il "corpo di fondo".
Ad esempio il comune sale da cucina (NaCl) e' solubile fino alla concentrazione di circa 6 M; pertanto se si prova a discioglerne una quantita' piu' grande di 34 g/ 100 ml si ottiene un corpo di fondo (100 ml e' circa mezzo bicchiere di acqua, provare per credere).
La massima concentrazione ottenibile di un soluto e' definita la sua solubilita' in quel solvente e la soluzione che la contiene e' definita satura. La solubilita' dipende dal composto considerato, dal solvente e dalla temperatura.
LA RELAZIONE FONDAMENTALE C=n/V
La relazione che correla la quantita' di soluto ed il volume della soluzione alla concentrazione:
C=n/V
Questa relazione vale cosi' com'e' per la molarita' e puo' richiedere piccole variazioni per le altre unita' di misura della concentrazione (ad es. C=n/Kgsolvente per la molalita').
Oltre a permetterci di calcolare la concentrazione della soluzione puo' essere usata per calcolare il numero di moli di soluto contenute in un certo volume di una soluzione a concentrazione nota: n=CxV
Inoltre nella medicina questa relazione viene utilizzata per le determinazioni dei volumi: V=n/C
DILUIZIONI. Una diluizione viene effettuata aggiungendo solvente puro ad una soluzione. Poiche' il numero di moli del soluto non cambia (in questo esperimento non viene ne' aggiunto ne' sottratto soluto ma soltanto solvente), la relazione fondamentale ci dice che:
n = C1 V1= C2 V2
Pertanto la concentrazione finale della soluzione risulta:
C2 = C1 V1 / V2
Il rapporto tra i volumi finale ed iniziale si chiama fattore di diluizione e poiche' V2 > V1, e' sempre maggiore dell'unita':
F = fattore di diluizione = V2 / V1
Vale quindi:
C2 = C1 / F
DILUIZIONI SERIALI. Quando sia importante ottenere diluizioni molto spinte (ad es. negli esami sull'attivita' anticorpale del sangue) non e' pratico diluire il campione fino alla concentrazione desiderata in un unico passaggio, e si ricorre al metodo delle diluizioni seriali.
Si supponga di dover diluire 10.000 volte 1 ml di siero di sangue. Il fattore di diluizione richiesto corrisponde a V2=10.000 x 1 ml = 10 l. Chiaramente effettuare questa diluizione non e' pratico. Si procede quindi in questo modo: si diluisce il campione a 100 ml realizzando una prima diluizione con fattore F1=100; poi si preleva 1ml della soluzione ottenuta e lo si diluisce di nuovo a 100 ml, quindi ancora con fattore F2=100.
OMEOPATIA. La medicina omeopatica fu codificata da S. Hahnemann tra la fine del 1700 e l'inizio del 1800.
I principi sui quali si basa sono i seguenti:
1) il farmaco efficace e' quello che causa nel sano gli stessi sintomi che la malattia causa nel malato (legge dei simili; similia similibus curentur)
2) il farmaco deve essere somministrato in forma pura e deve essre adatto al paziente (individualizzazione): deve cioe' causare nel sano tutti (o la maggior parte) dei suoi sintomi e possibilmente soltanto quelli.
3) il farmaco aumenta di potenza se viene diluito serialmente (potentizzazione; legge delle diluizioni o degli infinitesimi). E' importante che ad ogni diluizione segua una energica agitazione (succussione).
Il principio n.3, che si interessa in questa sede, era applicato da Hahnemann con il metodo delle diluizioni seriali centesimali (indicate come C o CH). Hahnemann utilizzava le potenze "basse" (3-6C), "medie" (10-15C) e "alte" (fino a 30C ed oltre) ed e' facile calcolare (con la formula 17) che anche alle medie diluizioni viene superato il numero di Avogadro; di conseguenza la dose somministrata al paziente della gran parte dei farmaci omeopatici non contiene neppure una molecola della sostanza da cui prende il nome.
Una analisi critica piu' dettagliata dei principi dell'omeopatia e' disponibile su questo sito web.
IL LIVELLO MICROSCOPICO. Come e' costituita la soluzione al livello microscopico, cioe' delle singole molecole?
Nel caso delle miscele gassose, le molecole semplicemente occupano lo stesso volume senza interagire chimicamente le une con le altre e sono soltanto mescolate tra loro; l'energia che favorisce questo stato e' di tipo ENTROPICO (cioe' probabilistico).
Nel caso delle soluzioni liquide, le molecole non si limitano ad occupare lo stesso volume, ma interagiscono tra loro ed il soluto puo' disciogliersi soltanto se e' in grado di stabilire interazioni deboli con le molecole del solvente; questo implica una certa similarita' tra soluto e solvente (ad es. soluti ionici o polari preferiscono solventi polari, mentre soluti apolari preferiscono solventi non polari). L'energia in questo caso e' sia ENTALPICA che ENTROPICA.
SOLUZIONI DI IONI. Gli elettroliti si disciolgono in solventi polari formando interazioni di tipo ione-dipolo, come nel caso della soluzione acquosa di cloruro di potassio riportata in figura:
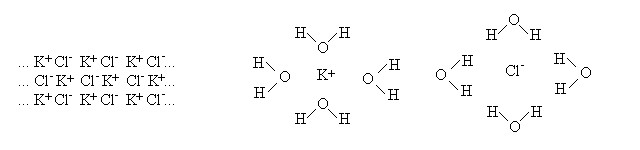
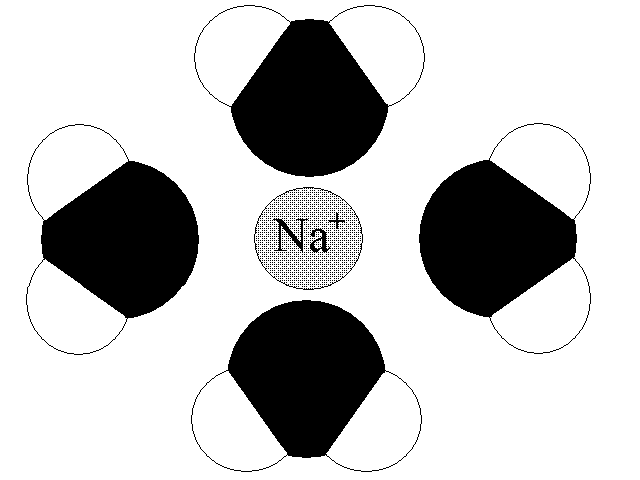
Lo ione in soluzione e' circondato da una prima sfera di molecole di solvente ("sfera di solvatazione"; se il colvente e' l'acqua "sfera di idratazione") ordinate rispetto alla loro polarita' e capaci di ordinare una seconda sfera di solvatazione, piu' debolmente legata, ed eventualmente una terza: ad esempio nella seguente figura e' disegnata la sfera di idratazione dello ione sodio
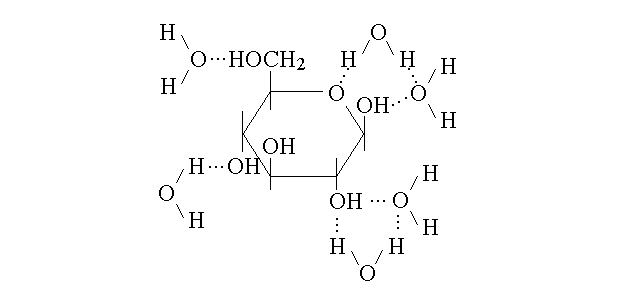
SOLUZIONI DI SOLUTI E SOLVENTI POLARI. Quando il soluto ed il solvente sono entrambi polari la sfera di solvatazione e' tenuta insieme da interazioni di tipo dipolo-dipolo. Un esempio di soluzione di questo tipo e' dato dalla coppia acqua-glucosio:
SOLUZIONI DEI GAS NEI LIQUIDI. Questo tipo di soluzione e' molto importante in medicina (si pensi agli scambi respiratori tra l'aria contenuta negli alveoli polmonari ed il sangue).
Se il gas non da reazioni chimiche con il liquido (ad es. ossigeno o azoto disciolti in acqua), la principale energia che governa la dissoluzione del gas e' l'entropia e non si formano affatto le sfere di idratazione. In questi casi il gas obbedisce alla legge di Henry, secondo la quale la concentrazione del gas e' direttamente proporzionale alla pressione parziale che esso esercita sulla superficie del liquido: C = k P
Se invece il gas reagisce con il solvente, esso si trova in soluzione in varie forme, e la legge di Henry si applica soltanto alla forma che e' uguale negli stati si soluto e gassoso; tutte le altre forme sono "in piu'". In genere un gas di questo tipo risulta alquanto solubile (e certamente piu' solubile di uno che obbedisce alla legge di Henry). Ad esempio l'anidride carbonica (un altro gas importante per la respirazione) si trova in soluzione come:
CO2 + H2O <==> H2CO3 <==> HCO3- + H+
LE ENERGIE CHE FAVORISCONO LA DISSOLUZIONE DEL SOLUTO.
ENTALPIA: e' l'energia che puo' essere assrobita o rilasciata in una reazione (ad es. nella formazione dei legami soluto-solvente caratteristici della sfera di solvatazione), in genere sotto forma di calore. Quando i legami chimici (forti o deboli) si formano viene emesso calore, mentre calore deve essere assorbito quando i legami vengono rotti. La dissoluzione di un soluto (solido o liquido) in un solvente liquido rompe i legami che esistevano tra le molecole di soluto e quelli che esistevano tra le molecole di solvente, e forma i legami tra soluto e solvente; il contributo entalpico finale puo' essere positivo o negativo. Ad esempio l'idrossido di sodio si discioglie riscaldando la soluzione ( i legami soluto-solvente sono piu' forti di quelli delle molecole del soluto tra loro e di quelli delle molecole del solvente tra loro) mentre l'urea si discioglie raffreddando la soluzione (e vale la considerazione opposta a quella del caso precedente).
ENTROPIA: e' una forma di energia diversa dall'entalpia e non si esprime sotto forma di calore; e' connessa con la numerosita' dei microstati del sistema. Si consideri il sistema immaginario formato da due sole molecole d'acqua contenute in un recipiente il cui volume e' pari a 100 volte quello di una molecola. Si definisca liquido il microstato in sui le due molecole formano un legame idrogeno tra loro e gassoso quello in cui non lo formano. Nel microstato liquido la prima molecola puo' occupare una posizione su 100 e la seconda deve trovarsi alla distanza di un legame idrogeno dalla prima; considerando che c'e' un piccolo numero di posizioni ugualmente adatte per la seconda molecola, il sistema ha qualche centinaio di microstati possibili. Nello stato gassoso la prima molecola puo' occupare una posizione su 100 e la seconda 1 su poco meno di 99, essendo escluse quelle che comportano il contatto con la prima: il sistema ha varie migliaia di di microstati. E' chiaro che lo stato gassoso ha maggiore numerosita' di microstati e risulta quindi piu' probabile.
Vi sono quattro proprieta' delle soluzioni che non dipendono dalla natura chimica del soluto ma soltanto dalla sua concentrazione; sono chiamate colligative e sono: la pressione osmotica, la variazione della pressione di vapore saturo, la variazione del punto di congelamento e la variazione del punto di ebollizione. Se il soluto e' un elettrolita e dissocia in ioni (oppure se dissocia per ragioni non elettrolitiche in particelle non cariche, caso piuttosto raro), ogni particella o ione si comporta come una molecola intera e la concentrazione dal punto di vista delle proprieta' colligative e' riferita alle particelle o ioni e non alle molecole indissociate. In questo corso sara' considerata la sola pressione osmotica, che ha maggior rilievo in relazione ai fenomeni biologici.
FENOMENI OSMOTICI. Il fenomeno dell'osmosi si verifica quando due soluzioni dello stesso solvente a diversa concentrazione sono separate da una membrana semipermeabile (cioe' permeabile al soluto ma non al solvente; non importa che il soluto nelle due soluzioni sia uguale o diverso, purche' non possa attraversare la membrana). Questi fenomeni sono importanti per la fisiologia cellulare e vascolare perche' le membrane che delimitano le cellule e i vasi sono in genere semipermeabili o selettivamente permeabili (cioe' permeabili ad alcuni soluti ma non ad altri).
Quando si ha osmosi tra due soluzioni, la soluzione a concentrazione maggiore estrae solvente da quella a concentrazione minore:
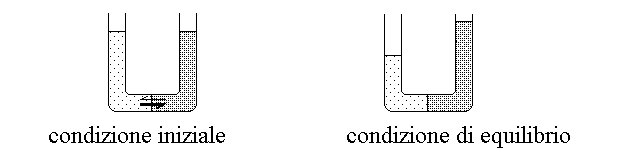
L'osmosi e' propriamente il flusso di solvente nei due sensi attraverso la membrana semipermeabile; pero' il flusso dalla soluzione piu' diluita a quella piu' concentrata e' maggiore di quello in direzione inversa. La forza che attrae il solvente verso la soluzione piu' concentratae' chiamata PRESSIONE OSMOTICA e, se l'esperimento fosse condotto in un sistema nel quale uno dei due compartimenti contenesse solvente puro, si misurerebbe la pressione osmotica della soluzione posta nell'altro compartimento. La pressione osmotica di una soluzione viene calcolata con la formula: π = Ceff R T
R e' la costante dei gas e, tenendo conto che C = n/V, si puo' osservare che la formula scritta sopra e' uguale all'equazione di stato dei gas perfetti. Ceff e' la concentrazione effettiva del soluto, cioe' la concentrazione misurata tenendo conto del numero di particelle effettivamente presenti in soluzione (se il soluto e' un elettrolita e dissocia ogni ione ottenuto si comporta come una particella indipendente e contribuisce a determinare la pressione osmotica).
Se un esperimento di osmometria viene condotto ponendo nei due compartimenti due soluzioni a diversa concentrazione, anziche' una soluzione ed il solvente puro, la pressione che si determina sperimentalmente e' pari alla differenza tra le pressioni osmotiche delle due soluzioni (ciasucna delle quali puo' essere calcolata con la formula riportata sopra).
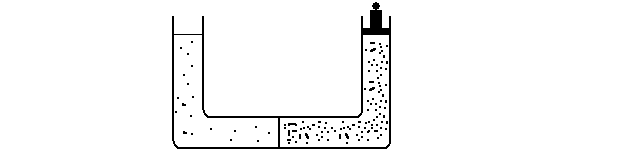
Come si misura la pressione osmotica in un esperimento come quello descritto? La pressione osmotica e' uguale nel modulo, ma opposta nel verso, alla pressione idrostatica che e' necessario esercitare sopra la soluzione a maggiore concentrazione per impedire il flusso netto di solvente dovuto all'osmosi:
LA PRESSIONE OSMOTICA DEI LIQUIDI BIOLOGICI. I liquidi biologici sono soluzioni acquose di molti soluti diversi e percio' di distinguono due tipi di pressione osmotica, in relazione al tipo di membrana semipermeabile considerata. Questa distinzione e' importante perche' alcune membrane, quali ad es. la membrana cellulare, sono pressoche' impermeabili a tutti o quasi tutti i soluti, mentre altre, quali quelle dei capillari sono impermeabili soltanto ai soluti a grande massa molecolare (e quindi non risentono della pressione osmotica dovuta ai soluti a basso peso molecolare).
1) La pressione osmotica vera e propria (ad es. tra i due versanti di una membrana cellulare) risulta dalla somma delle concentrazioni di tutti i soluti e corrisponde a circa 7,6 atm alla temperatura di 37oC; questo valore corrisponde ad una concentrazione effettiva complessiva di circa 0,3 M. Una soluzione che ha la stessa pressione osmotica totale del sangue si definisce ISOTONICA. Sono esempi di soluzioni isotoniche la soluzione di NaCl allo 0,9% peso/volume (soluzione fisiologica) o quella di glucosio al 5% peso/volume (soluzione glucosata); entrambe hanno concentrazione pari a 0,28 - 0,30 OsM e π = 7,6 atm a 37 C. Soluzioni a concentrazione maggiore sono definite ipertoniche, a concentrazione minore ipotoniche. Soltanto soluzioni isotoniche o molto prossime all'isotonicita' possono essere impiegate per l'infusione endovenosa.
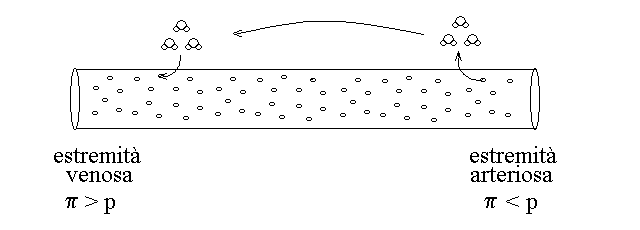
2) La pressione colloido-osmotica (o oncotica) dovuta soltanto ai soluti di grande massa molare (in genere si considerano tali quelli con PM > 30.000), quale si misura sui due versanti della parete di un vaso capillare, corrisponde a circa 26 mmHg (0,035 atm) a 37oC. Infatti il capillare ha dei pori che lasciano passare l'acqua e molti soluti a basso peso molecolare; la differenze di pressione osmotica tra l'interno e l'esterno dipende quindi dai soli soluti ad alto peso molecolare. All'estremita' arteriosa la pressione idrostatica dovuta alla spinta del cuore supera la pressione osmotica e forza il liquido ad uscire verso i tessuti; all'estremita' venosa avviene il contrario.
Torna a: didattica; pagina iniziale.