|
METODI DI LABORATORIO IN BIOCHIMICA Prof. ANDREA BELLELLI |
||||
| Metodi preparativi; omogenazione ed estrazione
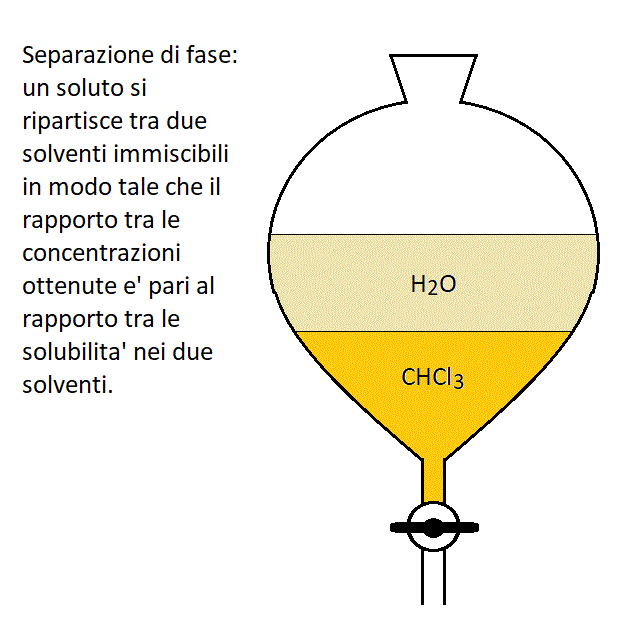
La cromatografia: La cromatografia e' una metodica preparativa o analitica che sfrutta la partizione della molecola di interesse tra due fasi: una stazionaria costituita in genere da una resina e l'altra mobile, costituita da tampone o solvente che fluisce attraverso la fase stazionaria. Filmato: la cromatografia; colonna cromatografica colonna cromatografica Il principio di separazione della cromatografia e' analogo alla partizione di un soluto tra due solventi immiscibili che puo' essere realizzata in un imbuto separatore:
In ogni straterello cilindrico di una colonna cromatografica si realizza una partizione di fase della macromolecola di interesse tra la fase stazionaria e la fase mobile. Poiché la fase mobile fluisce nella colonna cromatografica intanto che avviene l'equilibrazione, una estrazione completa richiede un settore di colonna di altezza definita, che viene chiamato un piatto teorico equivalente. L'ottimizzazione del flusso consente di minimizzare l'altezza del piatto teorico equivalente e quindi di moltiplicare gli eventi di partizione di fase sulla lunghezza della colonna. A seconda del tipo di resina (e quindi delle ragioni per le quali le macromolecole biologiche hanno affinita' per la resina) si distinguono: cromatografia a scambio ionico gel filtrazione cromatografia di affinita' cromatografia in fase liquida cromatografia a fase inversa gas cromatografia L'elettroforesi: L'elettroforesi e' una metodica che puo' essere usata sia per scopi analitici che preparativi e sfrutta il fatto che alcuna macromolecole biologiche (proteine, acidi nucleici) possiedono una carica elettrica, dipendente dal pH della soluzione in cui sono immerse, e possono quindi migrare in un campo elettrico. Per realizzare una elettroforesi una soluzione della macromolecola o della preparazione di inetresse, dializzata in un tampone diluito (10-20 mM) al pH desiderato viene deposta su una matrice gelificata, equilibrata nello stesso tampone. Alla matrice vengono quindi applicati due elettrodi e si applica una differenza di potenziale che fa migrare la proteina sulla matrice in funzione della sua carica. Al termine della corsa elettroforetica la matrice viene immersa in una soluzione di fissaggio (ad es. di acido acetico ed etanolo per le proteine) contenente un colorante che ha la funzione di rendere visibili le macromolecole biologiche. A seconda del colorante scelto possono essere rivelate le proteine, gli acidi nucleici o i lipidi (di solito contenuti in lipoproteine). tutorial fotografico sull'elettroforesi 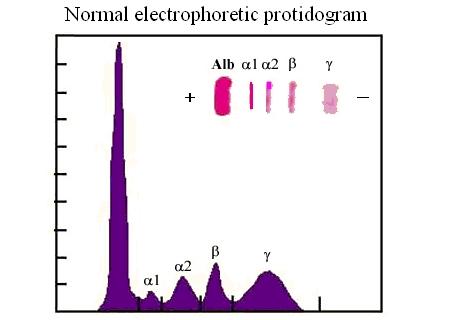
Centrifugazione e ultracentrifugazione: Dialisi: La dialisi e' una metodica che consente di cambiare il tampone in cui una macromolecola e' disciolta, o di rimuovere ioni e soluti a basso peso molecolare. Per realizzare una dialisi, la soluzione contenente la macromolecola di interesse viene versata in un tubo di cellophane di porosita' controllata e immersa in un ampio volume del tampone in cui si desidera equilibrare la macromolecola. Tecniche spettroscopiche: assorbimento Le tecniche spettroscopiche vengono applicate con finalita' analitiche per determinare la concentrazione o le proprieta' di (macro)molecole biologiche. Nella spettroscopia di assorbimento viene misurata la luce assorbita dal campione, in funzione della lunghezza d'onda: ad esempio lo spettro di assrobimento dell'emoglobina e' il seguente: 
Tutorial: principi e strumenti per la spettroscopia di assorbimento Tutorial: determinazione spettroscopica dell'affinita' di una proteina (mioglobina ferrica) per un ligando (ione fluoruro) |