PRIMA FACOLTA' DI MEDICINA E CHIRURGIA - CLUPS DIETISTA; INFERMIERE; TECNICO DI LABORATORIO
SAPIENZA UNIVERSITA' DI ROMA
La materia e' costituita da particelle piccolissime (atomi e molecole); questo spiega, ad esempio gli esperimenti di diffusione gassosa o la composizione percentuale in peso delle sostanze secondo rapporti precisi e costanti degli elementi costituenti. La chimica deve quindi descrivere la struttura di queste particelle, le piu' semplici delle quali sono gli atomi.
L'atomo e' costituito da un NUCLEO sentrale, che ne contiene quasi tutta la massa, e dagli ELETTRONI che ruotano intorno al nucleo:

Il NUCLEO dell'atomo e' a sua volta composto da due tipi di particelle: i protoni, dotati di carica positiva e i neutroni, privi di carica. La massa dei protoni e dei neutroni e' quasi uguale e costituisce l'UNITA' DI MASSA ATOMICA; corrisponde a circa un milionesimo di miliardesimo di miliardesimo di grammo. Si definisce NUMERO ATOMICO (Z) il numero dei protoni presenti nel nucleo dell'atomo; ovviamente Z e' uguale alla carica elettrica positiva complessiva del nucleo (misurata in unita' di carica atomica). Si definisce NUMERO DI MASSA (A) la somma del numero di protoni e di neutroni presenti nel nucleo. L'atomo e' indicato da un simbolo (di solito l'iniziale o le iniziali del suo nome in latino) a destra del quale si indicano, se necessario il numero di massa e il numero atomico:
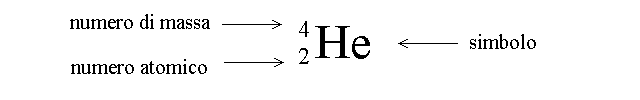
| TABELLA 1: | PARTICELLE | SUBATOMICHE | ||
| particella | massa U.M.A. | massa assoluta | carica elem. | carica assoluta |
| protone | 1,0007 | 1,67 x 10-24 g | +1 | 1,6 x 10-19 C |
| neutrone | 1,009 | 1,67 x 10-24 g | 0 | 0 |
| elettrone | 5,9 x 10-4 | 9,11 x 10-28 g | -1 | 1,6 x 10-19 C |
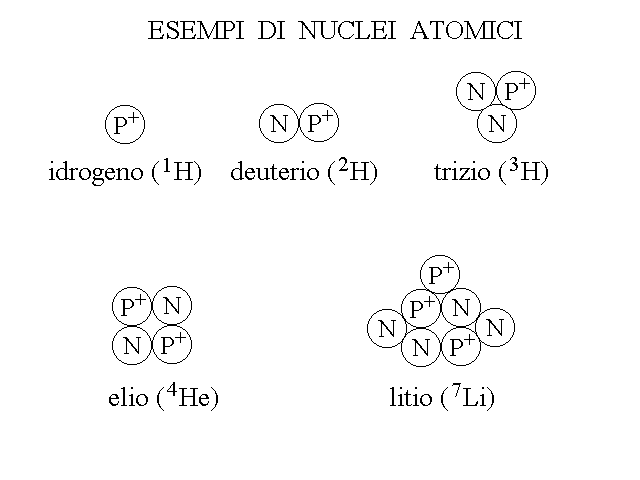
ISOTOPI. E' frequente che esistano nuclei con lo stesso numero atomico Z, ma diverso numero di neutroni e quindi diverso numero di massa A; questi nuclei (o gli atomi da essi costituiti) si chiamano ISOTOPI. Ad es. l'idrogeno (simbolo H) ha tre isotopi i cui nuclei sono costituiti rispettivamente da un protone (1H: Z=1, A=1); un protone e un neutrone (deuterio, 2H: Z=1, A=2); un protone e due neutroni (trizio, 3H: Z=1, A=3). Gli isotopi dello stesso elemento hanno la stessa reattivita' chimica (cioe' si combinano tra loro in modo equivalente ed indistinguibile; ad esempio l'acqua formata dall'isotopo 1H e quella formata dall'isotopo 2H e chiamata acqua pesante hanno la stessa formula chimica H2O).
REAZIONI NUCLEARI; RADIOATTIVITA'. Le particelle che compongono il nucleo atomico possono andare incontro a due tipi principali di trasformazioni:
P+ --> N + e+
N --> P+ + e-
Si noti nella prima reazione l'emissione dal nucleo di un elettrone positivo (positrone o antielettrone). Gli elettroni emessi dal nucleo nelle reazioni nucleari vengono chiamati, per ragioni storiche, particelle (o radiazioni) β e naturalmente possono essere dei due tipi β+ e β-.
Un altro tipo di reazione nucleare spontanea, che non comporta la trasformazione di una particella in un'altra, e' l'emissione dal nucleo di una particella α (alfa) costituita da due protoni e due neutroni e pertanto uguale ad un nucleo di elio.
Quando nel nucleo avviene una delle reazioni descritte, si ha il fenomeno della radioattivita'. La radioattivita' consiste nella trasformazione di un nucleo in un nucleo diverso ed e' associata all'emissione di radiazioni di tipo α, β+ o β-. In genere a queste radiazioni (dette particolate perche' costituite da particelle di materia) si associa anche l'emissione di radiazioni elettromagnetiche, non particolate, chiamate γ. La radiattivita' e' importante in medicina per tre ragioni:
1) gli isotopi radioattivi possono essere presenti nell'ambiente, entrare in contatto con l'organismo e danneggiarne i tessuti con le loro radiazioni: possono cioe' essere causa di malattie (ad es. alcune leucemie).
2) Gli isotopi radioattivi possono essere somministrati ai pazienti in piccolissime quantita' per scopi diagnostici, nell'esame chiamato scintigrafia. Questo perche' il loro accumulo in un organo bersaglio puo' essere rivelato facilmente (a causa delle radiazioni emesse) e puo' dare informazioni sul funzionamento dell'organo (ad es. nelle scintigrafie tiroidee si misura la capacita' della tiroide di captare lo iodio radioattivo).
3) Gli isotopi radioattivi si possono usare in quantita' elevate a scopo terapeutico per distruggere tumori non operabili (ad es. i tumori maligni della tiroide, se captano lo iodio, possono essere ridotti di dimensioni somministrando al paziente iodio radioattivo).
GLI ELETTRONI E GLI ORBITALI. Gli elettroni, che ruotano attorno al nucleo, hanno massa molto inferiore a quella dei protoni e dei neutroni e carica negativa di intensita' uguale (ma di segno opposto) a quella dei protoni. E' facile vedere che, essendo l'atomo elettricamente neutro, ed avendo l'elettrone carica uguale di intensita' ed opposta di segno a quella del protone, il numero degli elettroni deve essere uguale a quello dei protoni (cioe' uguale al numero atomico).
Il primo modello atomico che ebbe successo nello spiegare i dati sperimentali fu proposto dal fisico danese Niels Bohr ed e' QUANTISTICO: si intende con questo termine che l'elettrone ruota esclusivamente su alcune orbite stabili e puo' trovarsi soltanto a certe distanze dal nucleo.
LA DISPOSIZIONE DEGLI ELETTRONI INTORNO AL NUCLEO. Il modello atomico attuale e' derivato da quello di Bohr, e tiene conto del fatto che gli elettroni si muovono all'interno di aree dello spazio che circondano il nucleo ma sono meno ben definite delle orbite circolari ipotizzate da Bohr. In primo luogo non possiamo definire con precisione la posizione di ogni singolo elettrone e la sua velocita' (principio di indeterminazione di Heisenberg); in secondo luogo, a prescindere dalla precisione delle nostre misure, gli elettroni si muovono all'interno di regioni tridimensionali dello spazio perinucleare chiamate ORBITALI. Di fatto possiamo dire soltanto che esistono aree di spazio (gli orbitali) all'interno delle quali e' probabile trovare gli elettroni
I NUMERI QUANTICI. I parametri che definiscono la forma, l'orientamento e la posizione degli orbitali sono detti NUMERI QUANTICI e sono tre; un quarto numero quantico e' assegnato singolarmente a ciascun elettrone presente all'interno dell'orbitale considerato. Il NUMERO QUANTICO PRINCIPALE, n, assume soltanto valori interi maggiori di 1 e per gli usi pratici il massimo valore di n e' 5. Descrive il livello energetico principale, con buona approssimazione identificato gia' nel modello di Bohr ed annotato con lo stesso simbolo. I livelli energetici hanno la forma di gusci sferici cavi e concentrici, aventi nel centro il nucleo dell'atomo, come nella figura che segue.

Il NUMERO QUANTICO SECONDARIO, l, identifica il sottolivello al quale appartiene l'orbitale considerato e in pratica ne definisce la forma. Infatti se gli orbitali avessero tutti la stessa forma, gli orbitali dello stesso livello energetico sarebbero tra loro coincidenti e in pratica ogni livello non potrebbe ospitarnme che uno. Invece gli orbitali hanno forme diverse, definite dal numero quantico secondario l ad essi associato. Il numero quantico secondario assume tutti i valori interi positivi compresi tra 0 e n-1; pertanto al primo livello energetico (n=1) compete un solo tipo di orbitale (l=0); al secondo (n=2) competono due tipi di orbitali (l=0 e l=1); etc. L'orbitale con l=0 ha forma sferica ed e' chiamato orbitale s; l'orbitale con l=1 ha forma bilobata, a clessidra, ed e' chiamato orbitale p; i numeri quantici secondari superiori danno forme piu' complesse.
Il NUMERO QUANTICO MAGNETICO, m, descrive l'orientamento dell'orbitale nello spazio e puo' assumere come valore tutti i numeri interi, positivi e negativi, compresi tra +l e -l. L'orbitale s (qualunque valore di n, l=0) ha sempre e soltanto m=0; questo significa che in ogni livello e' presente un solo orbitale s, ed infatti data la simmetria della sfera non puo' esservi che un solo orbitale s in ogni livello; se ve ne fossero di piu' sarebbero necessariamente coincidenti e sovrapposti. L'orbitale p (n>1, l=1) puo' assumere tre valori di m corrispondenti a m=-1, m=0 e m=+1. Questo significa che ogni livello energetico superiore al primo contiene tre orbitali p, ciasuno ortogonale al piano individuato dagli altri due, e definiti rispettivamente px, py e pz.

| TABELLA 2: STRUTTURA ELETTRONICA DEI PRIMI 10 ELEMENTI | |||||||
| Elemento | A, Z | Protoni | Elettroni | ||||
| 1s | 2s | 2px | 2py | 2pz | |||
| Idrogeno (H) | 1, 1 | 1 | 1 | - | - | - | - |
| Elio (He) | 4, 2 | 2 | 2 | - | - | - | - |
| Litio (Li) | 7, 3 | 3 | 2 | 1 | - | - | - |
| Berillio (Be) | 9, 4 | 4 | 2 | 2 | - | - | - |
| Boro (B) | 11, 5 | 5 | 2 | 2 | 1 | - | - |
| Carbonio (C) | 12, 6 | 6 | 2 | 2 | 1 | 1 | - |
| Azoto (N) | 14, 7 | 7 | 2 | 2 | 1 | 1 | 1 |
| Ossigeno (O) | 16, 8 | 8 | 2 | 2 | 2 | 1 | 1 |
| Fluoro (F) | 19, 9 | 9 | 2 | 2 | 2 | 2 | 1 |
| Neon (Ne) | 20, 10 | 10 | 2 | 2 | 2 | 2 | 2 |
Note alla tabella 2: il numero di massa A e' riferito all'isotopo piu' abbondante; il numero atomico Z, il numero dei protoni ed il numero totale degli eelttroni coincidono per definizione; i tre orbitali px, py, pz sono energeticamente equivalenti ed e' arbitrario assegnare l'elettrone all'uno o all'altro di essi.
IL NUMERO QUANTICO DI SPIN. Ogni orbitale puo' essere abitato al massimo da due elettroni (prinicpio di Pauli). Gli elettroni oltre a muoversi all'interno dell'orbitale hanno un movimento di rotazione sul proprio asse chiamato spin e se in un orbitale sono presenti due elettroni, essi devono avere spin opposto (orario e antiorario). Il quarto numero quantico definisce la direzione dello spin dell'elettrone e puo' assumere i valori di +1/2 e -1/2.
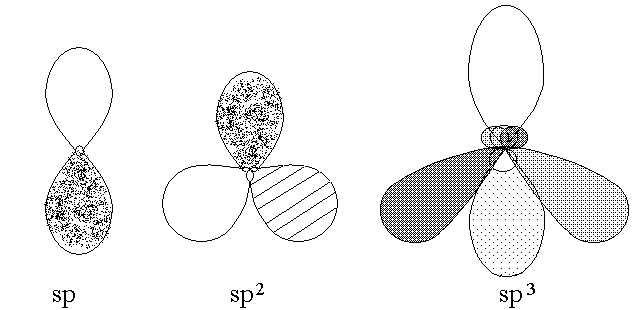
GLI ORBITALI IBRIDI sp, sp2 e sp3. Gli orbitali atomici appartenenti allo stesso livello energetico (cioe' contraddistinti dallo stesso numero quantico principale) possono fondersi e generare ORBITALI IBRIDI; un orbitale s ed un orbitale p formanu due orbitali ibridi sp; un s e due p formano tre orbitali ibridi sp2; etc.
IONI. Se un atomo perde un elettrone, la carica positiva dei protoni del nucleo non e' piu' esattamente bilanciata da quelle degli elettroni e si ottiene uno IONE POSITIVO (o catione), con carica elettrica netta pari a +1. La perdita di un ulteriore elettrone porta alla formazione di uno ione positivo con carica netta +2 e cosi' di seguito. E' possibile inoltre che un atomo isolato catturi l'elettrone perduto da un altro atomo ed acquisisca cosi' carica elettrica netta pari a -1; si ha in questo caso la formazione di uno IONE NEGATIVO (o anione). Uno ione e' definito come una specie chimica stabile che presenta carica elettrica netta diversa da zero e puo' essere costituito da un solo atomo (ione monoatomico, come nei casi descritti sopra) o da molti atomi legati tra loro, ed assomigliare quindi ad una molecola (ione poliatomico).
CONFIGURAZIONI ELETTRONICHE STABILI. Sebbene in linea di principio qualunque atomo possa formare molti ioni positivi e negativi, con diversa carica, in pratica ogni atomo forma soltanto uno o pochi ioni stabili. Ad esempio il sodio forma soltanto lo ione stabile monopositivo Na+, il calcio soltanto lo ione bipositivo Ca+2, il cloro lo ione mononegativo Cl-, etc. Le configurazioni elettroniche degli ioni stabili corrispondono al completo riempimento del livello elettronico esterno: ad esempio lo ione litio Li+ presenta la configurazione elettronica esterna 1s2, corrispondente al riempimento del primo guscio elettronico mentre gli ioni O-2 e F- presentano entrambi la configurazione elettronica esterna 2s2p6, corrispondente al riempimento del secondo livello elettronico (si faccia riferimento alla tabella 2). Queste configurazioni elettroniche sono quelle dei GAS NOBILI (He, Ne, etc.).
Gli atomi esistenti in natura possono essere ordinati in una tabella per numero atomico crescente:

La tabella cosi' ottenuta si chiama la TAVOLA PERIODICA DEGLI ELEMENTI ed e' ordinata in righe (PERIODI) e colonne (GRUPPI).
I PERIODI. La tavola periodica presenta 7 righe orizzontali, piu' o meno complete, dette periodi; ciascuna ospita un numero variabile di elementi: 2 per la prima riga, 8 per la seconda e la terza, 18 per la quarta e la quinta, etc. I periodi sono numerati dall'alto in basso in modo tale che quello che comincia con l'idrogeno (H) e' il primo e quello che comincia con il francio (Fr) e' il settimo ed ultimo. IL PERIODO CI DICE QUAL E' IL LIVELLO (o il numero quantico principale) PIU' ESTERNO ANCORA OCCUPATO DA ELETTRONI per l'atomo in questione. Pertanto l'idrogeno e l'elio, che appartengono al primo periodo, presentano i loro elettroni piu' esterni nel primo guscio elettronico, con numero quantico principale n=1; gli elementi dal litio al neon, che appartengono al secondo periodo presentano i loro elettroni piu' esterni nel secondo guscio elettronico, con numero quantico principale n=2, ed hanno ovviamente il primo livello elettronico completo (si faccia riferimento alla tabella 2).
I GRUPPI. Gli elementi di ciascun periodo della tavola periodica sono ordinati in modo tale che ciascuno appartiene ad una colonna; non sono cioe' sfalsati in verticale. Le colonne della tavola periodica si chiamano gruppi e indicano IL NUMERO DI ELETTRONI PRESENTI NEL LIVELLO PIU' ESTERNO PER L'ATOMO CONSIDERATO. Ad esempio l'idrogeno, il litio ed il sodio, che appartengono al primo gruppo presentano tutti un solo elettrone nel livello piu' esterno (che ha n=1 per l'idrogeno, n=2 per il litio e n=3 per il sodio). Gli elementi appartenenti allo stesso gruppo hanno reattivita' simile e spesso possono scambiarsi nei composti; per questo alcuni gruppi hanno un nome, che si impiega quando si vuole indicare indifferentemente uno qualunque degli elementi del gruppo. Gli elementi del I gruppo, con l'esclusione dell'idrogen, sono chiamati metalli alcalini; quelli del II gruppo metalli alcalino-terrosi; quelli del VII alogeni e quelli dell'VIII gas nobili.
L'ORBITALE DI LEGAME. Il legame chimico e' un orbitale (orbitale di legame) che si forma a seguito della sovrapposizione e fusione degli orbitali di due atomi, quando questi si trovano a brevissima distanza l'uno dall'altro. Perche' il legame sia stabile non e' sufficiente che si formi l'orbitale di legame, ma e' necessario anche che questo sia popolato da elettroni, e per il principio di Pauli, neppure l'orbitale di legame puo' essere abitato da piu' di due elettroni.
In genere i due atomi che devono formare il legame possiedono ciascuno un orbitale contenente un solo elettrone; a seguito della fusione dei due orbitali atomici, l'orbitale di legame si trova a contenere due elettroni, derivanti ciascuno da uno dei due atomi che hanno formato il legame. Un legame del tipo descritto si chiama COVALENTE e si dice che gli elettroni che abitano l'orbitale di legame sono messi in comune tra i due atomi.
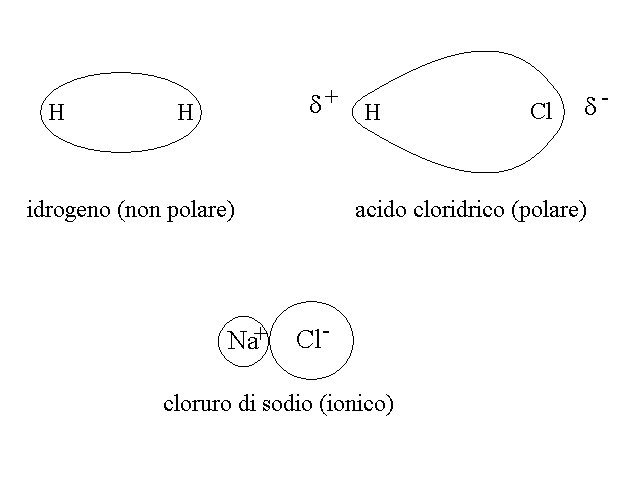
L'ORBITALE DI LEGAME σ (sigma). L'orbitale di legame piu' semplice che puo' formarsi tra due atomi si chiama orbitale σ (sigma) ha la forma di un ovoide che include i nuclei degli atomi coinvolti ai suoi poli e presenta la massima densita' elettronica al centro. Ad esempio nel caso del legame tra i due atomi di idrogeno che costituiscono la molecola di questo gas (formula: H2) si osserva quanto segue: ciascun atomo ha un solo elettrone, nell'orbitale 1s; la sovrapposizione e fusione dei due orbitali atomici 1s produce un orbitale di legame di tipo σ nel quale trovano posto i due elettroni, che negli atomi isolati erano spaiati.

La distanza tra i nuclei degli atomi che contraggono un legame e' caratteristica di quel particolare legame e dipende dalla forma e dall'energia degli orbitali atomici coinvolti; prende il nome di distanza di legame.
ENERGIA DI LEGAME. L'energia di legame tiene uniti i due atomi che lo costituiscono ed e' uguale nel modulo, ma opposta nel segno, all'energia che e' necessario fornire per rompere il legame stesso. Ad esempio:
Il simbolo H. (H punto) indica l'atomo di idrogeno con il suo elettrone spaiato e l'equazione ci mostra che la formazione di 1 grammo di idrogeno gassoso a partire dagli atomi isolati si associa alla liberazione di 52 kcal di energia. Rompere il legame e separare i due atomi richiede che sia fornita dall'esterno la stessa quantita' di energia.
POLARITA' DEL LEGAME COVALENTE. L'orbitale di legame che si stabilisce tra due atomi uguali e' perfettamente simmetrico ed il legame risultante e' definito COVALENTE OMOPOLARE (o omeopolare). Quando il legame chimico si stabilisce tra due atomi diversi, ciascuno attira gli elettronidi legame in misura dipendente dalla sua carica nucleare e dallo schermo formato dagli elettroni dei gusci piu' interni. Come conseguenza della diversa attrazione elettrostatica esercitata dai due atomi, l'orbitale di legame si deforma, diventa asimmetrico e la zona di massima densita' elettronica si avvicina all'atomo piu' elettronegativo. Il legame risultante e' definito COVALENTE POLARE (o eteropolare). Se la differenza di elettronegativita' e' molto grande si ha il completo trasferimente degli elettroni di legame all'atomo che li attrae piu' fortemente e la molecola ci appare come formata da due ioni di carica opposta uniti dall'attrazione elettrostatica (legame IONICO).
LEGAMI DOPPI E TRIPLI. Puo' accadere che due atomi che si trovano a distanza di legame si dispongano in modo tale da sovrapporre piu' di un solo orbitale; questo pero' accade soltanto se i vari orbitali che si sovrappongono possiedono un solo elettrone ciascuno. Ad esempio due atomi di ossigeno, con configurazione elettronica esterna 2s22p4, possiedono due orbitali p occupati da un elettrone spaiato e possono sovrapporli entrambi per formare due orbitali di legame, occupati ciascuno da due elettroni:
Tra due atomi puo' stabilirsi un solo orbitale di legame di tipo σ l'eventuale secondo orbitale di legame e' definito π (pi greco) ed ha forma bilobata, con aree di massima densita' elettronica sopra e sotto l'orbitale σ.
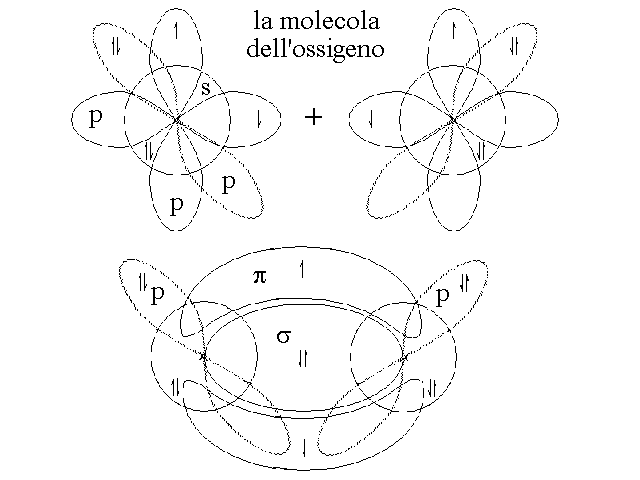
Nel caso in cui i due atomi possano sovrapporre tre orbitali ciascuno si puo avere la formazione di un legame triplo (ad es. nel caso della molecola di azoto, N2), costituito da un orbitale σ e da due orbitali π orientati a 90o uno dall'altro.
LEGAME DATIVO. In alcuni casi puo' accadere che un orbitale di legame si formi tra un orbitale atomico contenente una coppia di elettroni di un atomo, ed uno privo di elettroni di un altro atomo. In questi casi l'orbitale di legame (σ o π) risulta abitato da una coppia di elettroni che proviene da uno solo dei due atomi coinvolti e il legame viene percio' chiamato DATIVO. Un esempio di legame dativo si osserva nell'acido nitrico, HNO3 (che e' anche un esempio di delocalizzazione dell'orbitale di legame π e la cui formula e' riportata piu' avanti). In questa molecola l'atomo di azoto impegna i suoi tre elettroni spaiati in un legame semplice (orbitale σ) con l'ossigeno del gruppo OH e in un legame doppio (orbitali σ e π) con un secondo atomo di ossigeno. Il terzo atomo di ossigeno e' legato (mediante un orbitale σ) con un legame dativo formato da un orbitale atomico dell'azoto abitato da due elettroni e un orbitale privo di elettroni dell'ossigeno.
Le MOLECOLE sono strutture chimiche costituite da piu' atomi legati tra loro da orbitali di legame. Una porzione di materia costituita da molecole tutte uguali si chiama SOSTANZA o COMPOSTO CHIMICO. I composti piu' semplici sono quelli alla cui formula molecolare partecipano gli atomi di un solo elemento; questi sono i COMPOSTI ELEMENTARI, e sono in numero di poco superiore a quello degli elementi stessi, perche' ogni elemento ha almeno uno stato elementare e qualcuno ne ha due o piu'. Di poco piu' complicati sono i composti BINARI, alla cui molecola partecipano atomi di due tipi diversi, e alquanto piu' complicati sono i composti TERNARI o di ordine superiore.
COMPOSTI ELEMENTARI.
1) l'idrogeno e' un gas biatomico di formula H-H
2) l'elio e gli altri gas nobili hanno molecole monoatomiche: He, Ne, Ar, Kr, Xe, Rn
3) i metalli alcalini e alcalino terrosi (gruppi I e II) hanno la struttura molecolare del solido metallico
4) il boro forma un solido cristallino, ma e' raro in forma pura
5) il carbonio ha due stati elementari, il diamante e la grafite, entrambi solidi a struttura covalente
6) l'azoto e' un gas biatomico di formula N2
7) l'ossigeno e' un gas biatomico di formula O2
8) il fluoro e gli altri alogeni sono gas biatomici di formula F2, Cl2, Br2 e I2.
COMPOSTI BINARI.
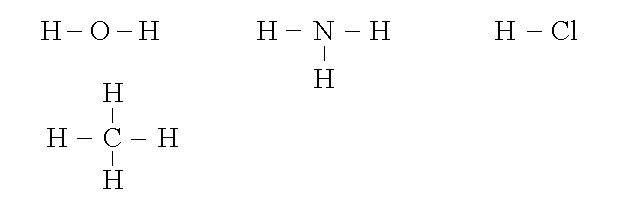
1) Composti binari dell'idrogeno (formula generale: HnXm): consideriamo l'acqua, l'ammoniaca e gli acidi alogenidrici (nei quali l'idrogeno e' combinato con un elemento del VII gruppo: ad es. HCl, HBr); inoltre gli idrocarburi, composti binari id idrogeno e carbonio (che sranno tarttati a parte), il piu' semplice dei quali e' il metano:
2) Composti binari dell'ossigeno: la nomenclatura chimica moderna li divide in ossidi, perossidi e superossidi. Una nomenclatura piu' antica ma ancora in uso distingue gli ossidi (composti dell'ossigeno con i metalli, nei quali sono presenti legami ionici e l'ossigeno ha lo stato di uno ione ossido O-2), dalle anidridi (composti dell'ossigeno con i non metalli nei quali i legami chimici sono covalenti polari). Consideriamo ad es. l'ossido di sodio (Na-O-Na) o l'ossido di calcio (Ca=O) e l'anidride carbonica (CO2, O=C=O).
3) I composti binari che non contengono ne' ossigeno ne' idrogeno costituiscono una categoria residua, piuttosto eterogenea; i piu' importanti per la medicina sono gli alogenuri (sali degli acidi alogenidrici nei quali l'idrogeno e' sostituito da un metallo, tra i quali ricordiamo il cloruro di sodio (NaCl, sale da cucina) e lo ioduro di potassio (KI, viene aggiunto al sale da cucina per prevenire l'ipotiroidismo da carenza di iodio).
COMPOSTI TERNARI.
I composti alla cui molecola partecipano atomi di tre elementi diversi sono definiti ternari e sono ovviamente assai numerosi. Sono particolarmente rilevanti per la medicina i composti ternari che comprendono idrogeno, ossigeno e un terzo elemento; escludendo ancora una volta i composti contenenti carbonio (oggetto di trattazione separata), definiamo idrossidi i composti nei quali il terzo elemento e' un metallo (ad es. l'idrossido di sodio: Na-O-H) ed ossiacidi molti tra quelli nei quali il terzo elemento e' un non-metallo (ad es. l'acido nitroso H-O-N=O).
ALCUNE DEFINIZIONI IMPORTANTI.
1) ACIDO: un composto ocntenente uno o piu' atomi di idrogeno legati ad un atomo fortemente elettronegativo con legame covalente polare. Quando l'acido viene disciolto in acqua il legame polare si rompe e vengono liberati lo ione idrogeno H+ e un anione; ad es.: HCl --> H+ + Cl-
Si chiama ossiacido un acido nel quale l'idrogeno dissociabile e' legato ad un atomo di ossigeno e idracido uno nel quale l'idrogeno dissociabile e' legato ad un atomo diverso dall'ossigeno. E' importante notare che non tutti gli atomi di idrogeno contenuti nella molecola dell'acido sono necessariamente dissociabili; ad es. la molecola dell'acido solforico (H2SO4) contiene due idrogeni dissociabili mentre in quella dell'acido acetico (CH3COOH) ce ne sono quattro ma soltanto uno (quello legato all'ossigeno) e' dissociabile.
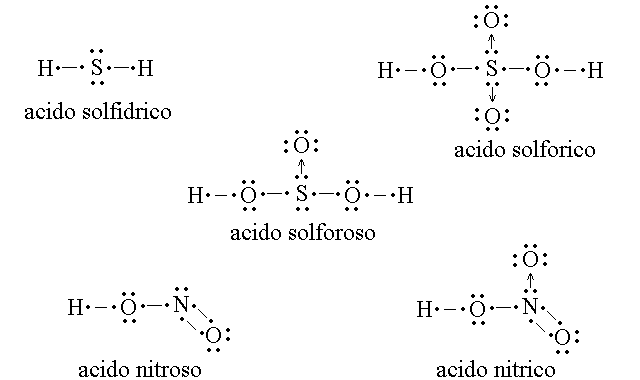
Il nome degli ossiacidi finisce in -oso o in -ico (ad es. HNO2 - acido nitroso; HNO3 - acido nitrico); il nome degli idracidi finisce in -idrico (ad es. HCl - acido cloridrico).
2) SALE: un composto nel quale due o piu' ioni sono tenuti insieme da legami ionici. Una caratteristica dei sali e' la dissociazione completa degli ioni costituenti in acqua. Ad es.:
NaI --> Na+ + I-
NH4Cl --> NH4+ + Cl-
Un sale puo' essere considerato come derivato da un acido per sostituzione dello ione idrogeno con uno ione positivo; e puo' essere prodotto facendo reagire un acido con una base. Ad es.:
H-O-N=O + NaOH --> Na-O-N=O + H2O
Poiche' si puo' considerare un sale come derivante da un acido, valgono le seguenti regole: il nome del sale di un idracido finisce in -uro (ad es. l'acido cloridrico da i cloruri e il solfurico i solfuri); il nome di un ossiacido finisce in -ito o in -ato (ad es. l'acido nitroso da i nitriti e l'acido nitrico da i nitrati).
DELOCALIZZAZIONE.
I nuclei degli atomi che costituiscono una moelcola vibarno intorno a posizione "medie"; gli elettroni possono invece saltare da un orbitale ad un altro (purche' questi non siano gia' completamente occupati. Questo comporta che in alcuni casi si possano scrivere per la stessa molecola due formule alternative, dette "di risonanza", che differiscono per la posizione di un orbitale di legame (cioe' per la posizione degli elettroni che lo occupano). Ad es. questo accade per l'acido nitrico:
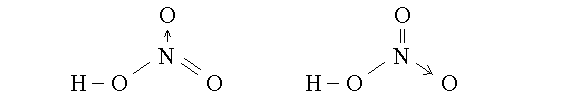
ALCUNI COMPOSTI IMPORTANTI PER LA MEDICINA.
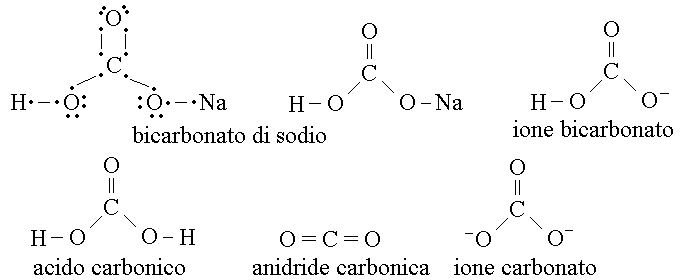
Il BICARBONATO e' un sale (in gen. di sodio o potassio) dell'acido carbonico; la dissociazione in acqua produce lo ione bicarbonato (HCO3-). Il bicarbonato puo' facilmente convertirsi in acido carbonico (e quest'ultimo in anidride carbonica) e in ione carbonato. Le formule di struttura sono:
I FOSFATI sono i sali o gli ioni derivanti dalla dissociazione dell'acido fosforico, importanti per la costituzione della matrice minerale dell'osso (in prevalenza formata da fosfato di calcio):
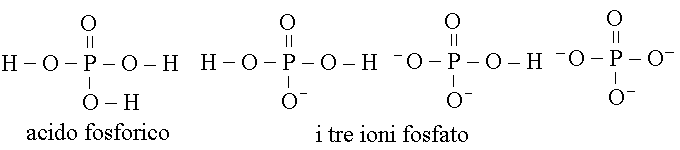
GLI ACIDI DELL'AZOTO E DELLO ZOLFO.
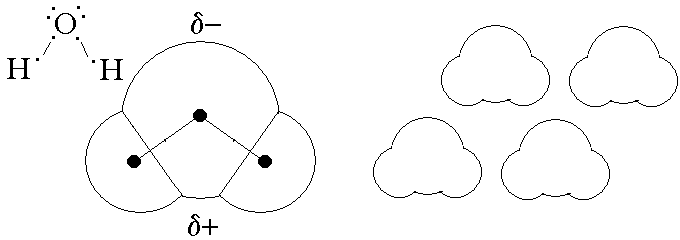
L'ACQUA. L'acqua e' il solvente dei liquidi biologici ed e' quindi molto importante nella medicina; il nostro corpo e' costituito da acqua per circa il 70% in peso. La formula e' H2O e l'atomo di ossigeno presenta ibridazione sp3 e geometria tetraedrica distora con angolo di legame di 105o. A causa della sue forma e della diversa elettronegativita' dell'ossigeno (3) e dell'idrogeno (2,1), la molecola dell'acqua e' un dipolo stabile che presenta il polo negativo sull'ossigeno e quello positivo tra i due atomi di idrogeno. Per questo motivo le molecole di acqua interagiscono tra loro in modo alquanto stabile; di qui l'elevata temperatura di ebollizione e varie altre proprieta' di questa sostanza.
Torna a: didattica; pagina iniziale.